概要
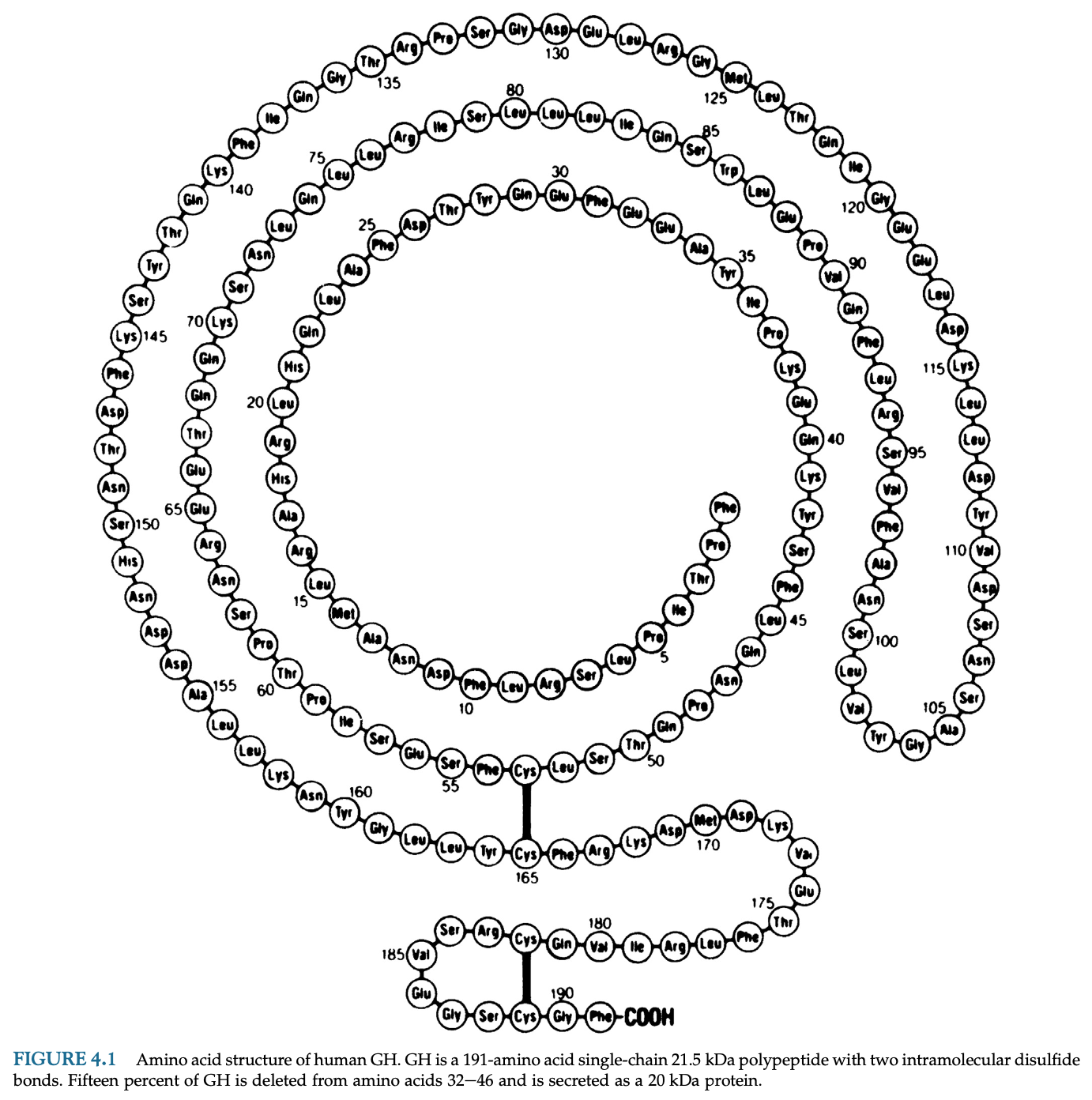
成長ホルモンは191アミノ酸からなる21.5kDaのポリペプチドで下垂体前葉のsomatotrophで産生され、成長促進と代謝調節の作用がある。
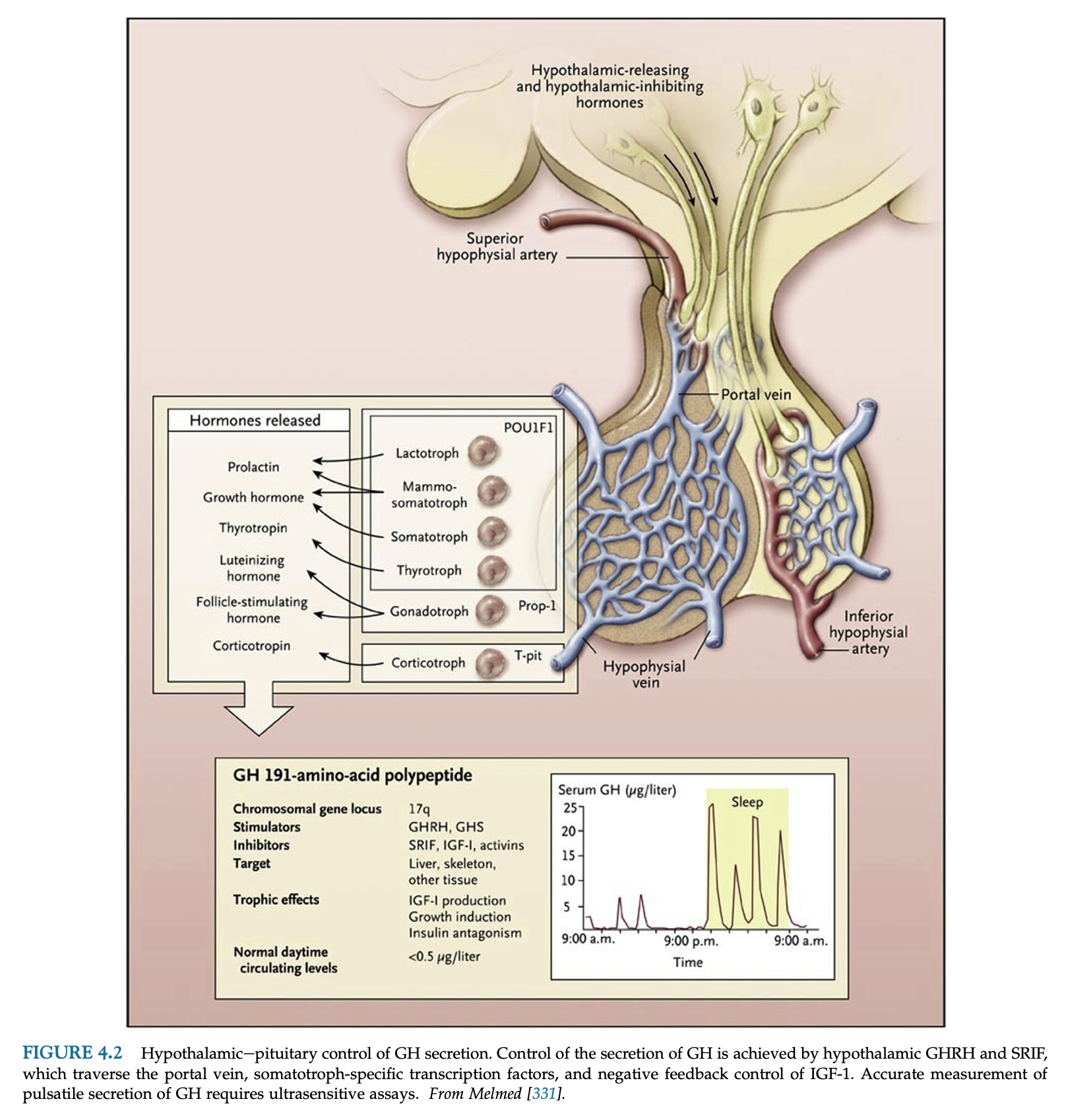
Somatotrophは下垂体前葉細胞の45%を占め、主に下垂体前葉の側翼に位置し、5-15mgのGHを含んでいる。somatotrophとlactotrophは好酸性細胞から成る。
成長ホルモン遺伝子
ヒトGH遺伝子ファミリーは5つの異なる遺伝子(GH1, chorionic somatomammotrophin hormone(CSH)1, CSH2, GH2, CSH4)からなり、染色体17q22-24に位置する。全て5つのエクソンと4つのイントロンから構成される。GH1は下垂体前葉のsomatotrophsで発現し、CSH1とCSH2は胎盤栄養膜細胞で発現する。GH2は妊娠中期から後期に胎盤合胞体栄養細胞で発現する。胎盤GH2の役割はよく分かっていない。
下垂体GH遺伝子(GH1)は2つのspliced mRNAをエンコードし、22kDaのGH分子と10%程度を占める32-46のアミノ酸が欠落した20kDaのGHを産生する。
大腸や乳房などの末梢組織でもわずかだがGHは発現しており、局所の微小環境に影響していると考えられる。
転写因子
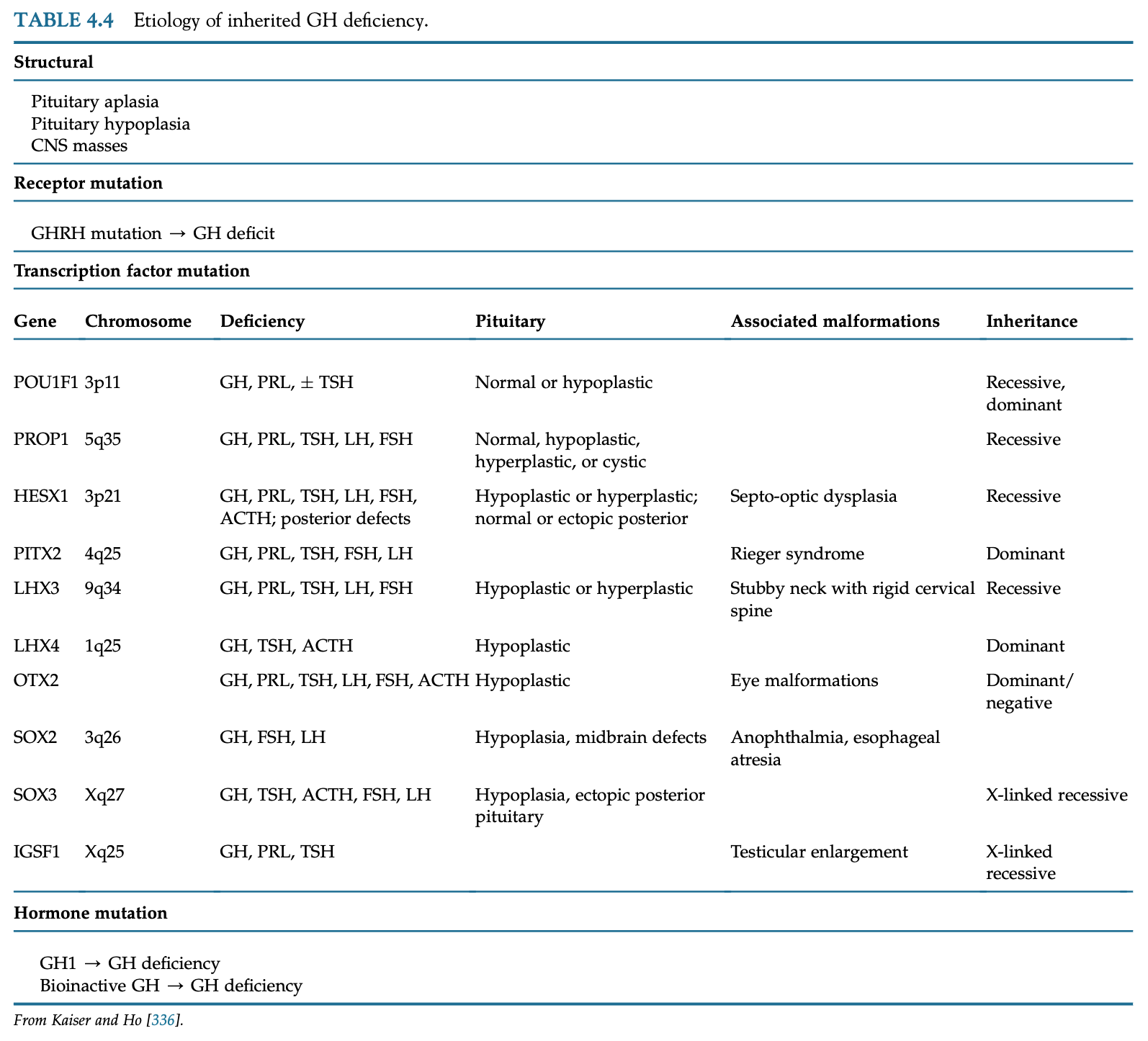
somatotrophとlactotrophへの分化・成長には転写因子であるPROP1とPOU1F1(Pit1)が必要となる。PROP1はPit1系列細胞への分化に必要となり、PROP1の遺伝子異常では低身長、甲状腺機能異常、性腺機能低下症、ACTH分泌低下症を伴う下垂体機能低下症を起こす。Pit1変異はGH、PRL、TSHの複合型下垂体機能低下症を起こす。遺伝性GH分泌不全症や過剰症はGH1遺伝子、GHRH受容体、GH受容体シグナル、非常に稀だがIGF-1関連分子の変異によって起こる。
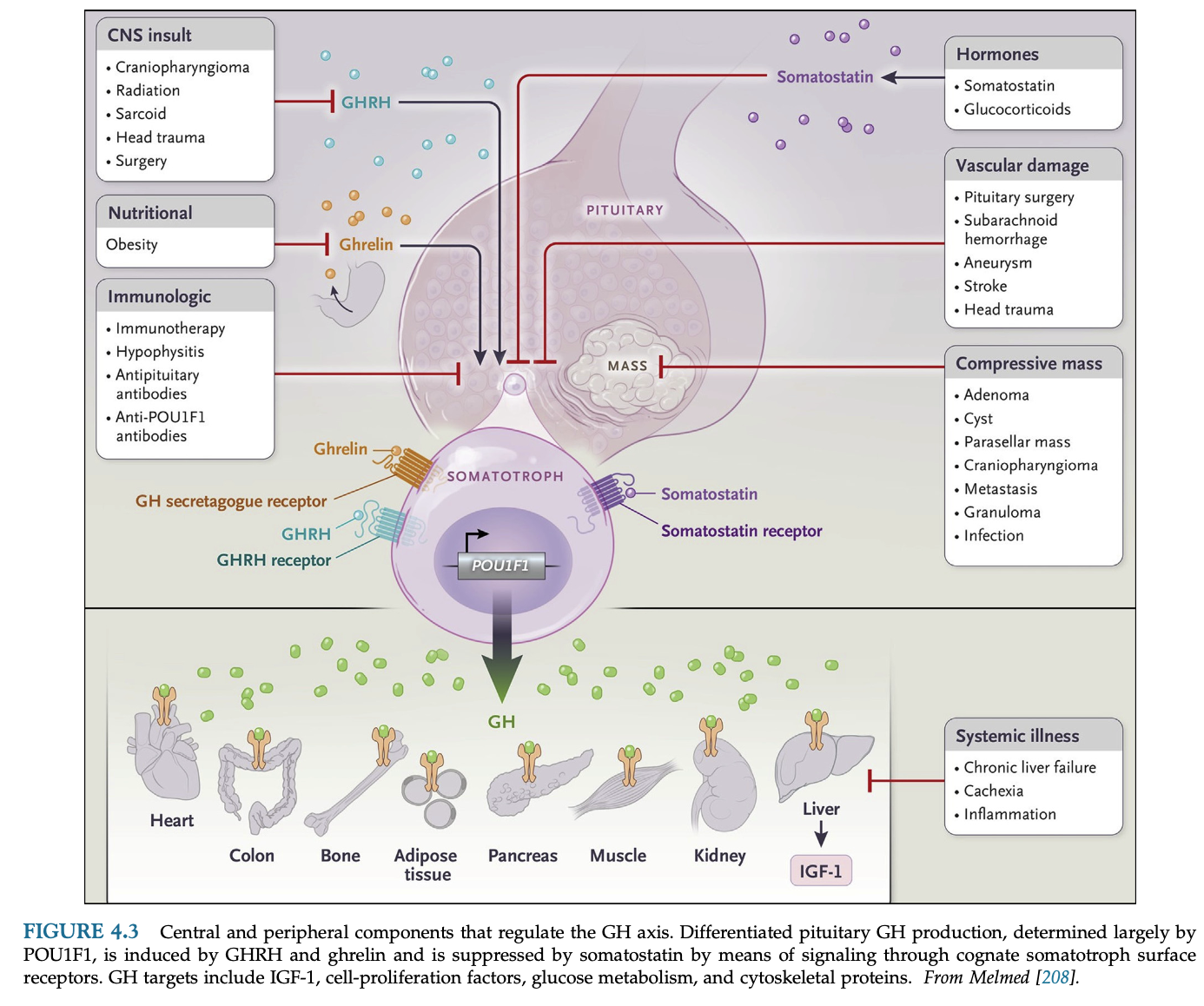
GHの制御
中枢神経におけるGHの制御は複雑である。
様々なペプチド・伝達物質・オピオイドが視床下部に作用してGHRHとソマトスタチンの分泌を調節し、その複雑の刺激の結果、最終的なGH分泌のパターンが決定する。
グレリン受容体(GHSR)はsomatotroph細胞と視床下部やその他の脳領域に発現しており、グレリンは視床下部と下垂体の両方のレベルからGHの分泌刺激を行う。グレリンはGHRHに対するGHの反応も強化する。GHSRノックアウトマウスはIGF-1低値と低体重だが、グレリン欠損マウスでは小人症を呈さない。
TRHは健常人ではGH分泌を刺激しないが、先端巨大症患者の70%でGH分泌を刺激し、これは一部の肝疾患・腎疾患・神経性食思不振症・うつ病患者でもみられる。
肥満患者ではGH分泌が顕著に抑制されているが、レプチンがGH分泌を抑制しているかもしれない。
ドパミンはGH分泌に影響する。レボドパ投与後にGH分泌は亢進する。中枢神経のドパミン受容体アゴニストのapomorphineもGH分泌を刺激する。
ノルアドレナリンはα刺激を通してGHを増やし、β刺激を通してGHを抑制する。
インスリン誘発性低血糖はα2刺激によってGHを増やすが、クロニジンはα1受容体に作用しGHを増やす。アルギニン、運動、レボドパ、バソプレシンはα刺激によってGH分泌を亢進させる。βブロッカーはGHRH刺激によるGH分泌を増やす。βブロッカーはインスリン低血糖、AVP、グルカゴン、レルドパによるGH分泌も増強させる。
アドレナリンはソマトスタチン分泌を減らすことでGHを調節している。
視床下部ホルモン
Growth hormone-releasing hormone(GHRH)
GHRH は視床下部の弧状核と乳頭前野のニューロンから分泌され、軸索は正中隆起に投射される。hGHRH遺伝子は、遊離アミノ末端とアミド化カルボキシ末端残基を持つ108アミノ酸のGHRH-44のプレプロホルモンをコードする。GHRHはVIP、グルカゴン、セクレチン、GIPと多少似たような構造を持ち、これら全てはGHRHには劣るがGH分泌刺激作用がある。
GHRHはsomatotrophのGHRH受容体に結合し、GH合成と分泌を促進する。ソマトスタチンはGHの基礎分泌とGHRH刺激によるGH分泌を抑制するが、GH合成は抑制しない。GHRHはGHのパルス状分泌の主要な調節因子であり、年齢によるGH低下もパルスの頻度や底値ではなくGHRHによる分泌のピークが低下するためと考えられている。
ソマトスタチン
プロソマトスタチンは視床下部前部脳室周囲核で合成され、軸索流によって下垂体門脈で終端する神経終末に輸送される。ソマトスタチンは膵島、消化管、神経、上皮細胞、視床下部外中枢ニューロンにも発現している。ソマトスタチンの血中半減期は2-3分と短く、GH・ACTH・TSHの分泌、TRHの(PRLではなく)TSHに対する刺激、およびインスリンとグルカゴンの膵分泌を阻害する。ソマトスタチンはGHRHのGH刺激、インスリン低血糖、運動、アルギニン、モルヒネ、レボドパ、睡眠によるGH分泌も抑制する。
ソマトスタチン受容体は5種類あり(SSTR1-5)、ヒト下垂体には主にSSTR1,2,5が発現しており、下垂体腺腫ではSSTR1,2,3,5を発現する。先端巨大症において使用されるソマトスタチン製剤は主にSSTR2とSSTR5に結合する。
GH分泌調節におけるGHRHとソマトスタチンの相互作用
視床下部から独立したパルスで分泌されるGHRHとソマトスタチンは相互作用し、GHの拍動性分泌を生む。またGH分泌は標的成長因子であるIGF-1のネガティブフィードバックを受ける。GHは肝臓や末梢組織におけるIGF-1合成を刺激し、IGF-1は視床下部・下垂体にネガティブフィードバックを起こす。IGF-1は視床下部からのソマトスタチン分泌も起こす。
抗ソマトスタチン抗体を投与すると、GH基礎値が上昇しGHパルスは変化しないことから、ソマトスタチンはGHのnadirを形成する役割がある。抗GHRH抗体はGHパルスを消失させる。異所性GHRH産生腫瘍はGHRH静注ではGHパルス状分泌が持続することから、ソマトスタチンも脈動的分泌に大きく関与していることが示唆される。
GHRHとソマトスタチンは相乗的に作用しており、ソマトスタチンの前投与はその後のGHRHによるGH分泌を高めることから、GHトラフ中のソマトスタチン高濃度が次のGHRHパルスによるsomatotrophによるGH分泌を最適化していると考えられる。
GH分泌に影響する生理的因子
GH分泌はパルス状で、パルス間の底値ではほぼ測定感度未満となる。
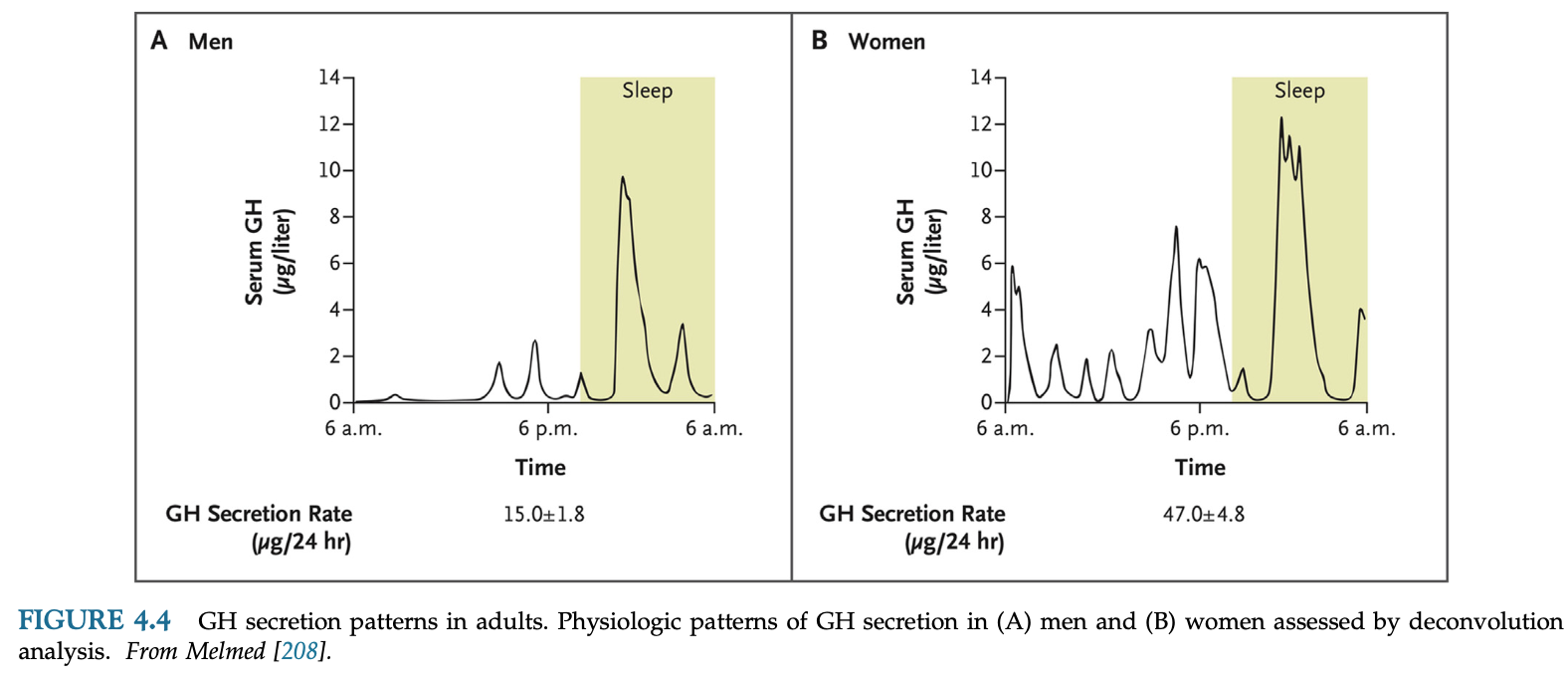
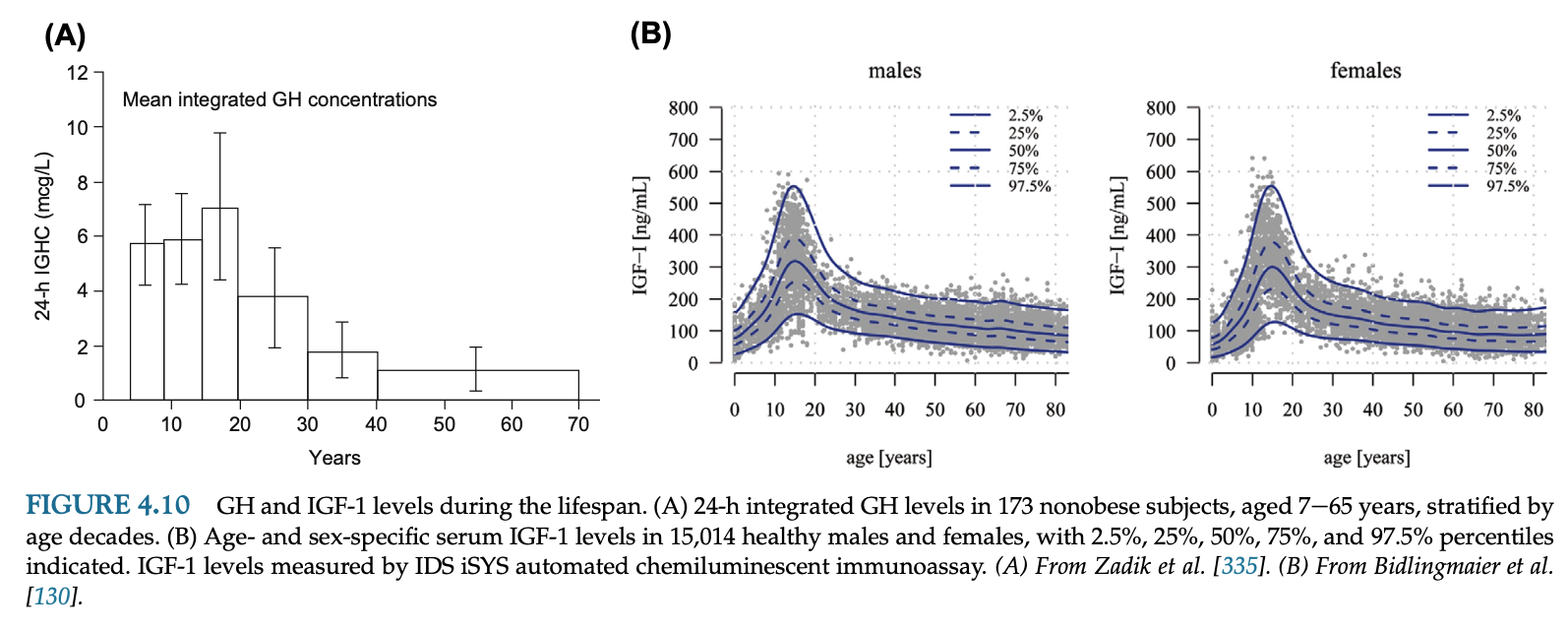
GHの総分泌量は男性より女性で多く、閉経後女性にエストロゲン補充するとGH分泌は増える。健常人ではパルス分泌によるGHが24時間の総GHの85%以上を占める。GH分泌量の変化はパルスの頻度ではなく、パルスで分泌される量の変化による。バーストサイズはGHRHで増え、ソマトスタチンで減り、GHRHとグレリンはシナジー効果でさらに増強する。他の多くの二次的な因子として性別、性腺ホルモン、内臓脂肪、妊娠、思春期、加齢、運動、睡眠、アミノ酸、脂肪酸、グルコース、空腹、インスリン、IGF-1、GHフィードバックが関与する。GH値は加齢とともに低下する。加齢はソマトスタチン過剰分泌、GHRH分泌低下、グレリン不足などによってGH分泌刺激に対する反応の低下を起こす。
女性はGHピーク値の高値によって平均GH値が高いが、GH半減期やパルス間隔・頻度に差はない。これは女性においてOGTT後のGH底値が高いことを示唆する。GH分泌の約60-70%は睡眠初期の徐波睡眠のときに起きる。運動はGH分泌を刺激する。
GHはトラウマや循環血漿量減少性ショック、敗血症などの身体的ストレスによっても分泌される。しかし悪性腫瘍など慢性的な消耗性疾患ではGH値は上昇しない。アドレナリン刺激によるGHRH分泌がストレスによるGH分泌を起こしている。
栄養と代謝による調節
栄養と代謝因子はGH分泌に深く影響する。慢性栄養障害や5日間の絶食はGH上昇と関連する。これはIGF-1低化によるネガティブフィードバックの解除の結果と考えられる。
GH分泌のパルスの頻度と振幅が絶食によって増加する。対称的に、肥満ではGHの基礎分泌と刺激分泌が減り、その減衰は総体脂肪と内臓脂肪の量と相関する。肥満患者ではGHRHに対する反応が低下する。
インスリン誘発性低血糖はグルコーストラフから30-45分後にGH分泌を刺激するが、急性高血糖はGHを1-3時間抑制し、その後リバウンドで3-5時間上昇する。インスリン誘発性低血糖はGH分泌刺激試験のゴールドスタンダードである。
アルギニンおよびロイシンの静注はGH分泌を急速に刺激する。血中遊離脂肪酸の減少はGHを分泌させ、遊離脂肪酸の増加はアルギニン静注や睡眠、レボドパ、運動などのGHRHによるGH分泌を弱める。
デキサメタゾンは先端巨大症患者のGHを抑制し、生理量以上のグルココルチコイドは成長遅滞の原因となる。クッシング病では成長遅延とGH減少が明らかとなる。健常人ではグルココルチコイドはGHRH誘発性GH分泌を抑制しうるが、急性投与ではGHを分泌させる。よってグルココルチコイドは短期間ではGHに対して刺激効果があるが、慢性的過剰な場合にはGHを抑制する。
GH結合蛋白
GHは特異的蛋白と結合する。1つは高親和性で1つは低親和性である。
60kDaの高親和性GH結合タンパク質(BP)は、GH受容体(GHR)の細胞外ドメインに相当し、タンパク質分解切断により生成される。
血中22kDaのGHは高親和性BPに結合し、20kDaのGHは低親和性BPに優先的に結合する。
結合によってGHの代謝クリアランス率を低下し、血中半減期が延長する。
高親和性BPはまた、リガンドと競合することによってGHRとGHの結合を阻害し、急性の血清GH変動による影響を減衰させる。高親和性BP濃度は、胎児および新生児では低く、出生後1-2年で上昇し、成人期を通じて一定である。
成人のGHDにおけるGH補充は、GHBPの変化とは関連しない。先端巨大症において、GHBP値を測定しても診断上の有用性はない。
GH受容体
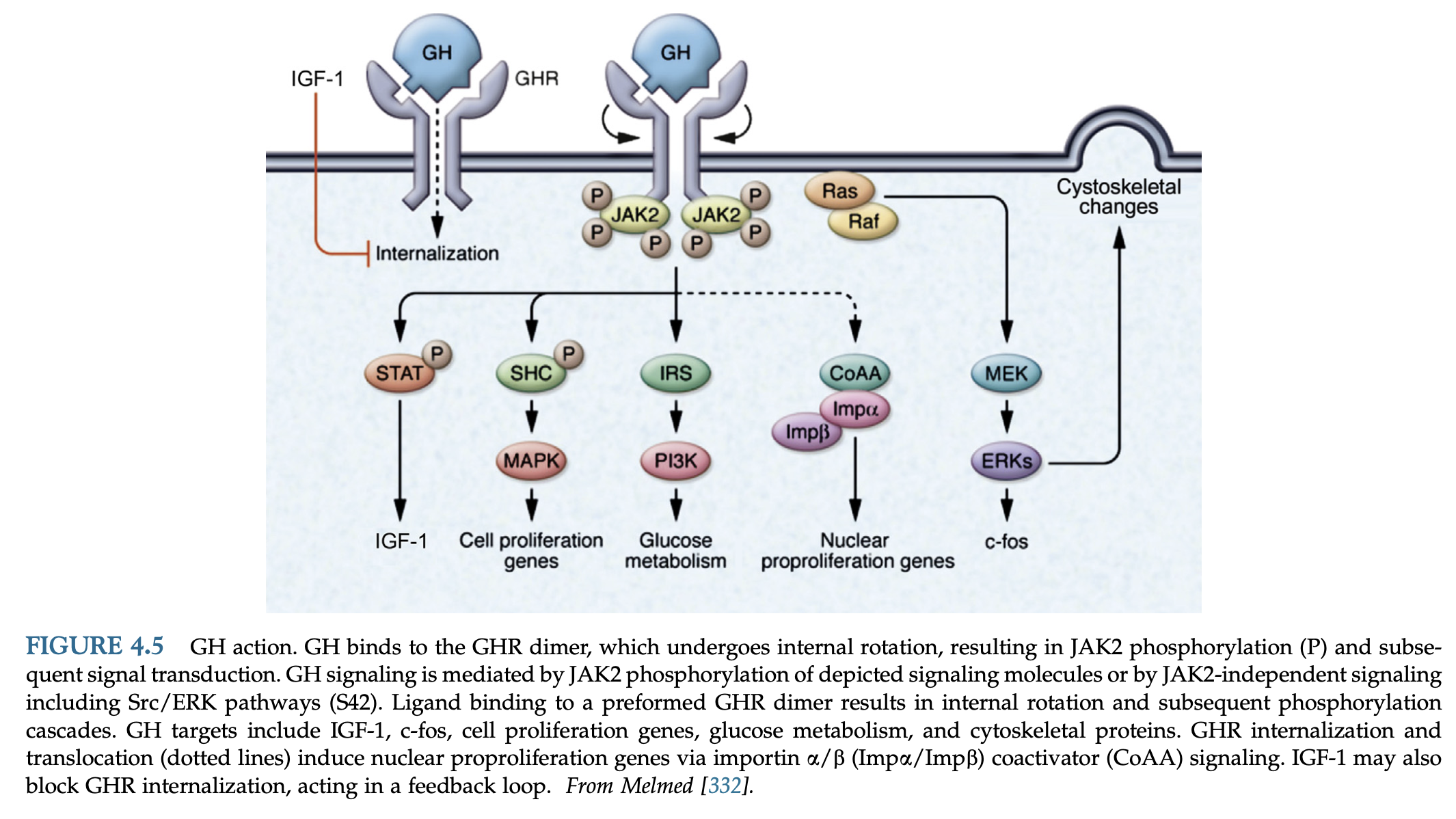
GHはその末梢受容体(GHR)に結合し、JAK/STATリン酸化カスケードを介した細胞内シグナル伝達を誘導し、また、強力な成長・分化因子であるIGF-1の合成を誘導することによって間接的に作用する。GHRは70kDaのタンパク質で、細胞外リガンド結合ドメイン、膜貫通ドメイン、細胞質シグナル伝達ドメインからなるクラスIサイトカイン/造血レセプターである。活性化された受容体二量体はJAK2部位の分離を誘導し、GHRの回転はJAK2チロシンキナーゼの活性化によって誘導され、GHR自体やGH作用のシグナル伝達成分であるシグナル伝達転写活性化因子(STAT)を含む細胞質シグナル伝達分子のリン酸化につながる。リン酸化された細胞質タンパク質は核に移行し、GH特異的な標的遺伝子の発現を引き起こす。
GHによって誘導される他の標的作用には、c-fos誘導、IRS-1リン酸化、インスリン合成、細胞増殖、細胞骨格の変化などがある。GHによって活性化されたSTAT5Bは、IGF-1の転写を直接誘導し、それによってGH誘導性の体細胞成長を媒介する。
肝臓には豊富なGHRが存在し、筋肉と脂肪にもある程度の量が発現している。
STAT5Bは、GHを介した生後の成長、脂肪細胞の機能、およびGHの肝作用の性的二型に必要である。STAT5Bを不活性化したトランスジェニックマウスは、成長障害を示し、IGF-1レベルが低く、GHの注射に低反応となる。
GH受容体変異は、部分的または完全なGH不感受性および成長不全と関連し、正常または高い血中GHレベル、GHBPレベルの低下、およびIGF-1低値を示す。
ヒトでは、STATの突然変異は低身長と相対的なGH低感受性をもたらす。
GHの作用
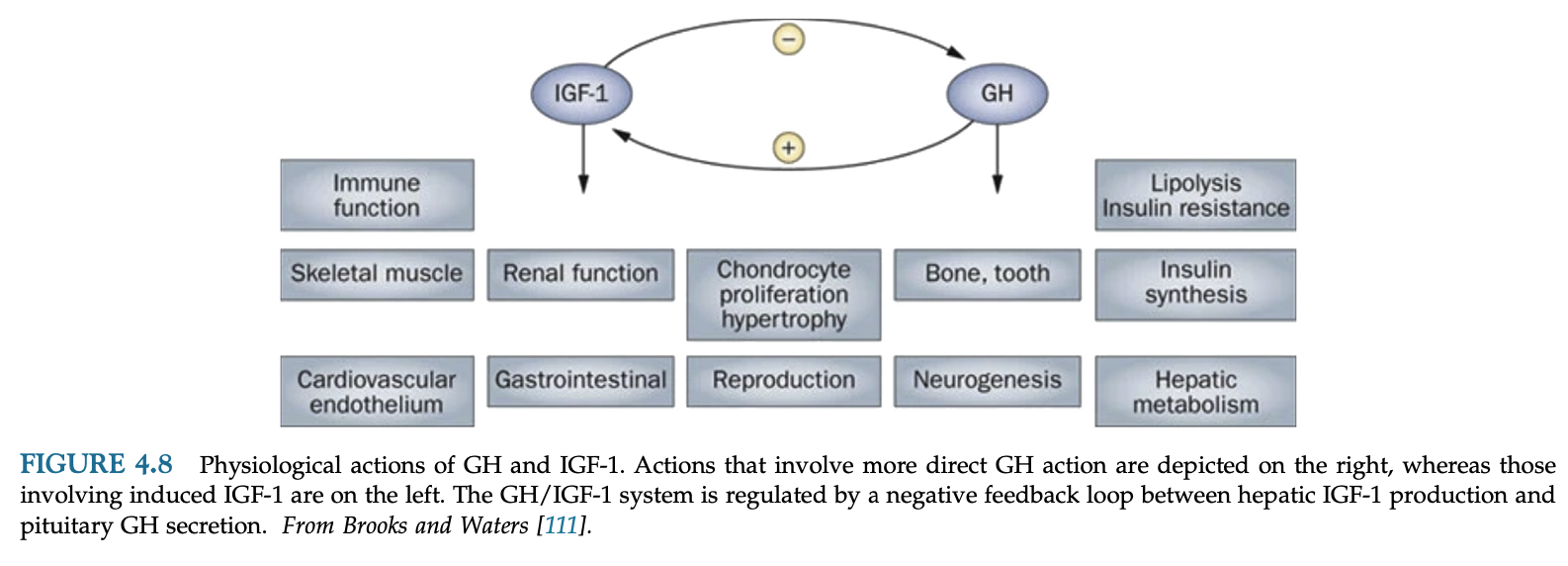
GHは代謝とホメオスタシスを調節し、生後の成長と発達に極めて重要な役割を果たす。
GHの作用の大部分は、標的組織でGHによって誘導されるIGF-1によって媒介されるが、GHは直接作用も示す。IGF-1はまた、GHとは無関係に合成され、骨成長促進作用のようにGHと相乗的に作用することもあれば、肝グルコース代謝のように拮抗的に作用することもある。
生涯にわたる成長と発達におけるGH/IGF-1の役割
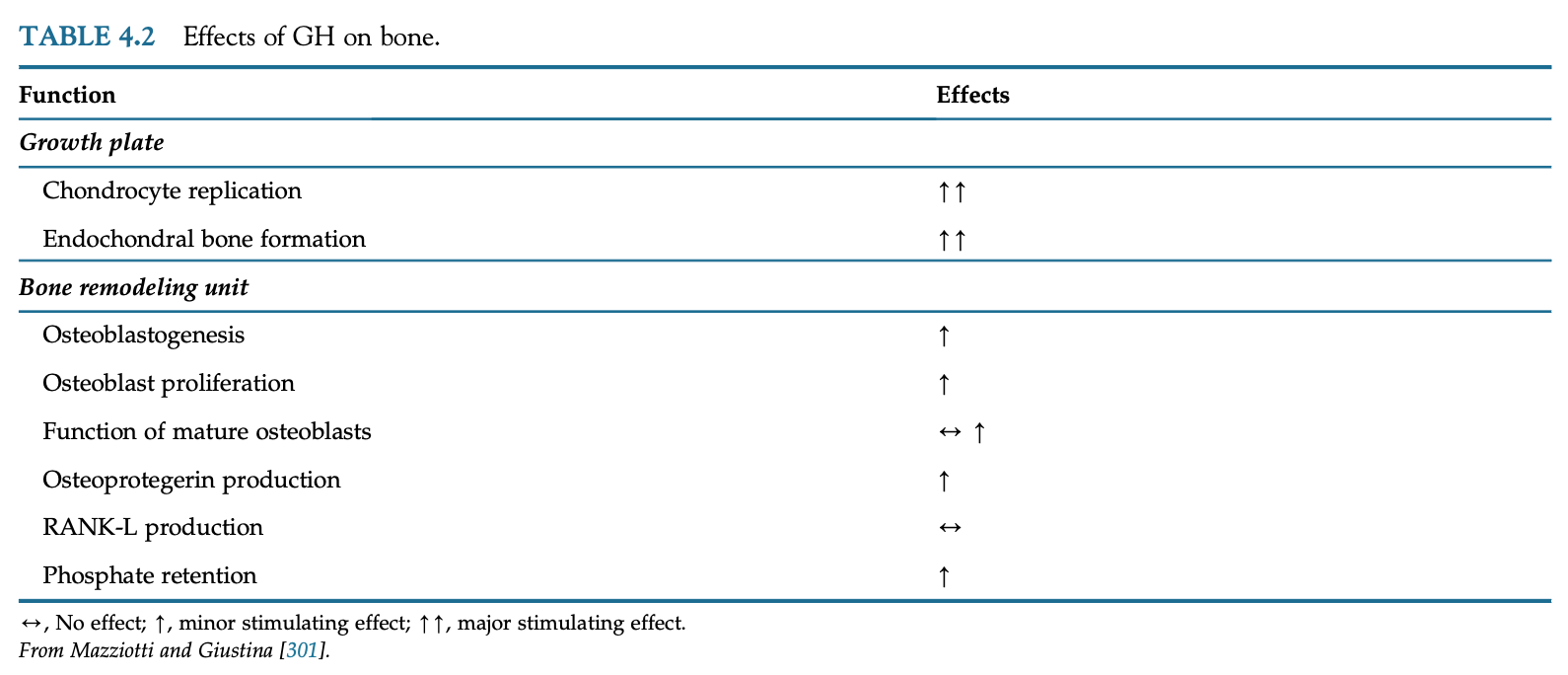
長骨の骨端成長板における縦方向の骨成長は、軟骨内骨化によって媒介される。
軟骨細胞はGHRを発現しており、GHが存在すると、間葉前駆体は脂肪新生よりも軟骨新生と骨芽細胞新生を好む。遺伝・ホルモン・栄養は、新しく形成された軟骨への血管および骨細胞前駆体の侵入に影響し、骨梁の石灰化(軟骨内骨化)を促進する。
GHは骨芽細胞の増殖を刺激し、IGF-1はGHの骨芽細胞同化作用に必要となる。
GHはまた、成熟骨芽細胞の機能を、直接またはIGF-1を通じて間接的に刺激し、オステオカルシンのカルボキシル化を促進する。
血清IGF-1低値のGHR変異マウスでは、成長板が小さく、骨量減少がみられ、皮質骨が減少しているが、海綿骨は正常である。これは、血中IGF-1が海綿骨よりも皮質骨により顕著に作用していることを示唆している。一方で、IGF受容体を骨芽細胞特異的にノックアウトしたマウスは、骨芽細胞数と機能の低下を示し、骨形成と海綿骨の体積が減少することから 、海綿骨の維持において骨格性IGF-1がより重要な役割を果たしていることが示唆される。
GHとIGF-1はともに、生涯を通じて骨代謝に影響を及ぼす。
胚発育期には、IGF-1とIGF-2はGHとは無関係に作用する骨成長の重要な決定因子であり、GHR変異やGHシグナル伝達経路の欠陥によるGH欠乏や不感受性は、出生前の成長ではなく、出生後の成長を著しく損なう。
このように、GHは胎児の成長を決定する上で重要な役割を果たしていない。しかしながら、出生後および思春期には、GHとIGF-1の両方が、思春期前期の骨格成熟および骨量の獲得や縦方向の骨格成長を決定する上で重要である。GHは成人の骨格量の維持にも関与している。GH欠乏症の小児は低身長を示し、小児期のGH過剰症は巨大症を引き起こす。
対照的に、IGF-1欠乏を引き起こすIGF1遺伝子変異およびIGF1受容体遺伝子変異によるIGF-1抵抗性は、出生前および出生後の成長障害と関連している。
したがって、全身的および局所的な骨格GHおよびIGF-1の同化作用は、骨量の獲得および骨格構造の維持、特に骨量のピーク達成に重要な青年期後期および成人期において重要である。
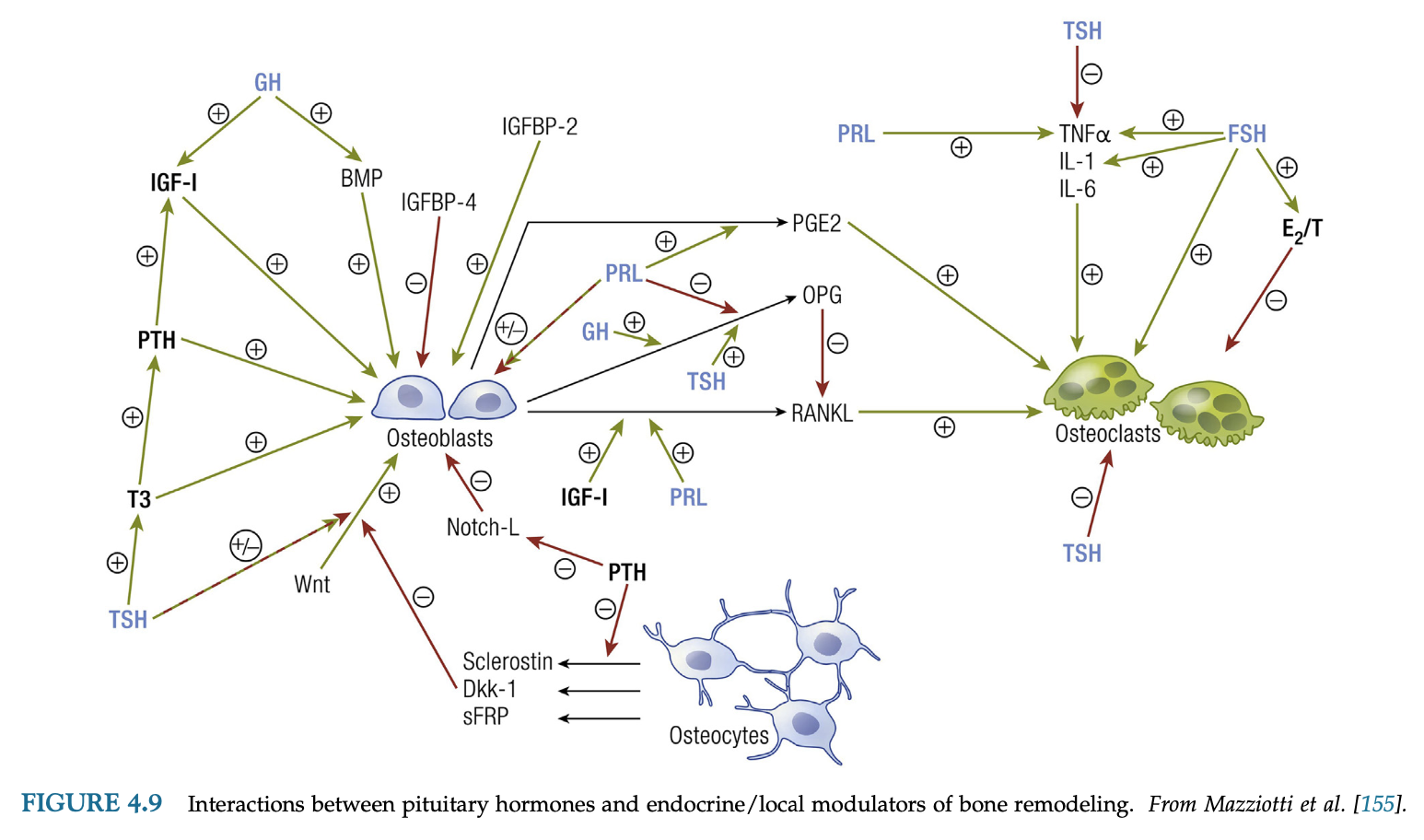
骨の獲得と骨量減少
GHは、出生後および思春期の成長期において、縦断的な骨成長と骨密度(BMD)のピーク到達を促進する。小児期に発症したGH欠乏症は、成人期の骨折リスクの増加およびBMDの低下と関連しており、GH補充により回復する。IGF-1は、発育の全段階を通じて成長に必要であり、GH依存性およびGH非依存性の機序の組み合わせにより、骨形成率を促進し、十分なBMDおよび大腿骨の長さに寄与する。骨形成を制御するIGF-1の作用は、皮質骨と海綿骨、および骨軸部と骨端部で異なるが、独立した作用とGHとの相乗作用の両方が、ピーク骨量の達成に不可欠である。IGF-1の欠乏は、明らかにBMDの減少および成長遅延と関連している。
GHは、IGF-1とは無関係に骨吸収と骨回転を増加させ、GH過剰の患者は骨折リスクが高くなる。さらに、加齢に伴うGH分泌の低下により、骨喪失が起こる可能性がある。血清IGF-1およびIGFBPレベルも加齢とともに低下し、骨形成細胞の減少を伴う。成人のGHD患者では、骨回転率の低下、骨粗鬆症、骨折リスクの増加がみられる。GHDの発症期間と年齢、および疾患の重症度は、骨喪失の程度に影響する。
GHの代謝作用
GHの分泌は成人期になっても続き、重要な代謝機能を担っている。
GHの作用は、脂肪を除くすべての組織において同化作用があり、GHは貯蔵脂肪を異化してエネルギーを放出し、他の組織の成長を促進する。
急性には、GHとインスリンは相乗的に作用し、正常な成長・代謝・分化・発育を促進する。しかし慢性的なGHの作用は、インスリンの作用に拮抗し、複数の機序を介して多臓器(肝臓、骨格筋、脂肪組織)におけるインスリン抵抗性を促進する。
糖質代謝に対するGHの作用は、主に抗インスリン作用であり、蛋白質代謝に対しては同化作用を示す。GH欠損の小児は軽度の肥満であり、GH補充により体脂肪が減少し、最終的には皮下脂肪細胞のサイズと脂質含量が減少する。GH欠乏性成人は、体組成が変化し、脂肪が増加し除脂肪体重が減少する。

脂質
GHは主に内臓脂肪の脂肪細胞の分解を刺激し、遊離脂肪酸を増加させ、筋肉と肝臓のリポ蛋白リパーゼを増加させ、トリグリセリドの取り込みを促進する。
GH欠乏成人では、総コレステロール、LDL、トリグリセリド、アポリポ蛋白Bが上昇し 、HDLが低下しており、これらはすべて動脈硬化や心血管疾患に関連している。除脂肪体重は年齢、性別、身長をマッチさせた正常対照者の予測値と比較して減少し、脂肪体重は増加する。GH欠乏症では、過剰な脂肪は主に腹部中心の分布で内臓コンパートメントに蓄積し、全身の水分は減少する。GH補充により、GH欠乏成人では除脂肪体重が増加し、脂肪量が4-6kg減少し、内臓脂肪が最も顕著に減少する。
糖代謝
GHはインスリン作用に拮抗し、脂肪組織における糖取り込みを減少させる。肝臓では、GHはグリコーゲン分解を増加させ、肝糖新生を増加させる。
GH欠乏小児では、空腹時血糖が低下し、インスリン分泌が減少しており、糖利用の増加と肝糖放出の鈍化による耐糖能障害とインスリン感受性の増加という相反する障害がみられる。これらの特徴と一致して、GH補充は空腹時血糖、インスリン値、および肝グルコース産生を増加させる。GH欠乏成人では、空腹時インスリン値が上昇し、脂肪量およびウエスト周囲径と相関する。短期間のGH補充(6ヵ月未満)は、インスリン感受性をさらに低下させるが、報告されている成人のGH欠乏症におけるインスリン感受性に対するGH投与の長期的効果は様々であり、GH投与の用量と期間および他の併用ホルモン欠乏症に依存する。
先端巨大症における慢性的なGH過剰曝露は糖尿病原性であり、患者はインスリン感受性の低下を示し、基礎インスリン値の2-3倍の上昇、血糖値の上昇、食後のインスリン分泌の低下がみられる。
生殖機能
男性および女性の生殖系はGH作用の標的であり、またGH合成の場でもあることから、生殖系におけるGHのオートクライン/パラクリン作用の存在が示唆される。
GHと性腺系は相互作用し、思春期の開始、性的成熟、思春期成長の加速に関わる。
男性では、GHは精巣および付属器官で発現し、オートクリン/パラクリン作用により、おそらくIGF-1を介した精細管の分化および精巣の成長が促進される。GHは、in vitroでLeydig細胞によるアンドロゲン・エストラジオール産生を刺激し、配偶子形成を促進する。GH療法を慢性的に受けているGHDの男性では、hCGによるテストステロンの産生が改善する。
女性では、GHはステロイド生成、卵胞形成、および卵子の成熟を調節し、生存可能な胚に至るプロセスを最適化する。実際、GHDの女性は生殖能力が低下しており、GH補充によりGHD女性の自然妊娠率は改善する。生殖系に対する複数のGH作用により、卵巣の反応が不良な女性において、生殖補助医療としてGHが使用されるようになり、生殖成績が改善される例もあるが、出生率は改善していない。
心血管機能
GH・IGF-1受容体は心筋および血管に発現しており、GH/IGF-1軸は心筋量を維持し、パフォーマンスを向上させ、心筋収縮力を調節する。
GHDにおける血圧と末梢抵抗の結果は相反し、血圧の上昇、低下、変化なしなどさまざま。
GHDの成人は、腹部脂肪の増加、インスリン抵抗性、易凝固性、総コレステロールおよびLDLコレステロールの高値、HDLコレステロールの低値、運動能力および肺活量の低下などの心血管リスクを有する。
先端巨大症では、血漿量の増大、平滑筋細胞の増殖刺激による血管抵抗の増大、およびインスリン抵抗性の増大により、高血圧の有病率が高い(20%~50%)。しかし、健常者と比較して冠動脈疾患、頸動脈アテローム性動脈硬化症、頸動脈内膜中膜厚の有病率が増加することはない。
未治療の先端巨大症患者には、心拡大、心室肥大、置換性線維症、心筋細胞の変性が起こる。20%が弁膜症を、7%から40%が心臓不整脈を起こす。
腎機能
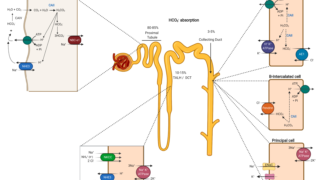
GH/IGF-1軸は糸球体の細胞に作用し、メサンギウム細胞の増殖と移動、足細胞の機能抑制によって、糸球体濾過量を増やす。GHとIGF-1は腎臓の発達、糸球体機能、および尿細管においてナトリウム・カルシウム・リン・グルコースを調節する。GH受容体は、近位・遠位尿細管の上皮細胞、メサンギウム細胞、近位尿細管直部の足細胞、ヘンレのループの髄質肥厚部上行脚と集合管および遠位ネフロンに存在する。腎臓のIGF-1は血中を循環するIGF-1と腎臓局所で産生されたIGF-1の両方が作用する。GHは遠位尿細管におけるナトリウムと水の再吸収を刺激する。またGHはおそらく成長中のリン需要に応えるため、尿細管におけるリンの再吸収を促進する。先端巨大症では腎肥大、糸球体濾過量増加、液体貯留、高P血症がみられる。
GH分泌試験
GH分泌はパルス状に行われるので、随時のGH測定は成長ホルモン分泌不全症や先端巨大症の診断に役立たないことが多い。そのため非生理的な刺激試験や抑制試験がGH分泌を評価するために行われる。
GH過剰分泌の評価
先端巨大症では常に血清IGF-1値が高値を示す。GH過剰分泌の評価として用いられるのは75g-OGTTである。健常人ではOGTT後にGHは抑制されるが、先端巨大症では正常範囲に抑制されず、むしろ増加することもある。75g-OGTTでGHが0.4ng/mL未満に抑制されない場合にGH過剰分泌と診断する。
GH欠乏の評価
GHの随時採血はGHDの診断に役立たない。IGF-1低値はGH欠乏を示唆するが、栄養不良・急性疾患・セリアック病・コントロール不良の糖尿病・肝疾患・エストロゲン投与の場合にもIGF-1低値となりうる。負荷試験でGHDと診断された小児の15%はIGF-1が正常範囲内であった。IGF-1値は常にGH負荷試験後のGH値を相関しているわけではなく、GHDの小児ではIGFBP-3低値も起こる。さらに重要なこととして、成人GHDの20%はIGF-1値が正常範囲内である。
GH分泌負荷試験
GHDに対する負荷試験は臨床的にGHDが疑わしい状況で行われるべき。
GH刺激剤にはインスリン、クロニジン、アルギニン、レボドパ、GHRH、プロプラノロール、グルカゴン、グレリン受容体作動薬がある。成人GHDの診断は、一つ以上の負荷試験で誘発されたピーク血清GHレベルの増加が鈍化していることを示すことによって確立される。
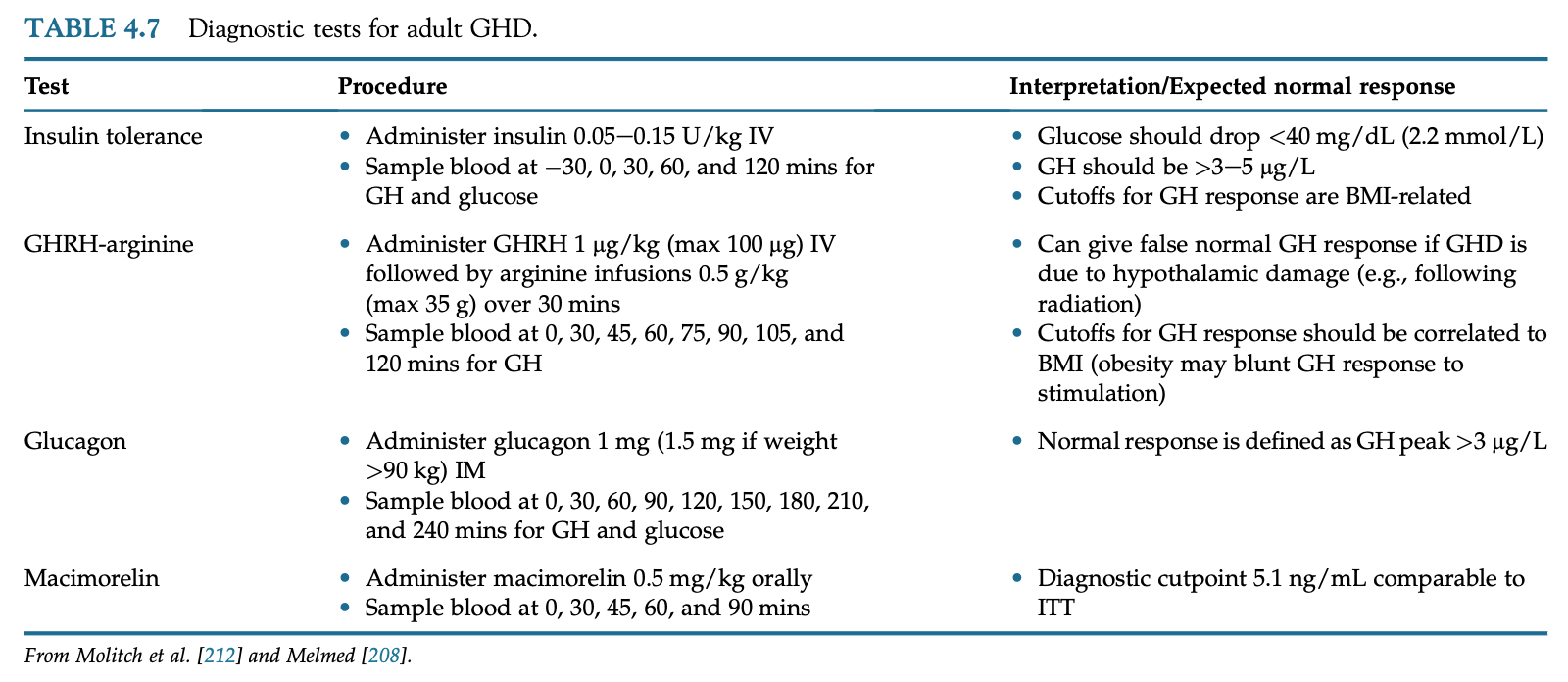
インスリン低血糖試験
インスリン低血糖試験(ITT)はGH分泌に対する信頼性が高い検査であり、歴史的かつゴールドスタンダードの負荷試験である。レギュラーインスリンを0.05-0.10IU/kg静注して血糖値を45mg/dL以下にする。GHは30-60分後にピークになる。患者はめまい、不安、発汗、動悸、けいれん、稀に意識障害など低血糖症状を呈するかもしれない。よってITTはてんかん、冠動脈疾患を既往に持つ患者には禁忌であり、55歳以上の患者は注意を要する。ITTは副腎機能を同時に評価できることが利点である。
クロニジン
クロニジンはαアドレナリン作動薬でGH分泌を刺激する。クロニジン0.15/m2経口投与60-90分後にGHはピークとなる。患者は眠気を感じることがあり、GHDの成人の用量(0.25-0.30mg)でナトリウム欠乏があると低血圧を起こすことがある。クロニジンは小児のGH刺激試験として使用されうことがあるが、成人のGHDの評価法としては信頼性がない。
アルギニン/GHRH
アルギニンは視床下部のソマトスタチン分泌を抑制することで、GHRHに対するsomatotrophの反応を増強する。GHRH(1mg/kg)静注とアルギニン(30g)を30分点滴後に、30分毎に120分までのGH値を測定する。アルギニン/GHRHに対する反応は年齢非依存性であり、ITT並みに鋭敏な検査である。ITTが禁忌または現実的でない場合に代替の検査として用いられる。本邦ではアルギニン負荷のみ行われ、ピーク値が3ng/mL以下でGHDの診断、1.8ng/mL以下で重症GHDの診断項目となる。
GHRP
GH-releasing peptides(GHRPs)は合成のGH分泌刺激薬であり、グレリン受容体に結合することで用量依存的かつ特異的にGH放出を起こす。経口GH分泌促進剤のmacimorelinは安全かつ便利でありITTと同様の効果があり、成人GHD診断において感度82%、特異度92%である。GHのカットオフ値はBMI<30の患者では6.8ng/mL、BMI>30では2.7ng/mLである。本邦ではGHRP-2が用いられ、GHピーク値が9.0ng/mL未満で重症GHDの診断項目となる。
グルカゴン
グルカゴンはITTと同等もしくはそれより弱いGH分泌能がある。グルカゴンによるGH分泌のメカニズムは完全には分かっていない。グルカゴン1.0mgを皮下注し、30分毎に180分までGH値を測定する。グルカゴン刺激は栄養不良の患者や48時間以上絶食している患者には行うべきではない。副作用に嘔気や遅発性低血糖がある。正常な反応はGHピーク値が3ng/mL以上となる。1.8ng/mL未満で重症GHDの診断となる。
GH分泌負荷試験の考え方
GH負荷試験は時間と費用、高い偽陽性率のため、患者は以下の基準の1つを満たすべき。
1)低身長のためにGH治療を要し、解剖学的・遺伝的・後天的な原因があり、青年期から成人期に以降する若年成人。
2)下垂体病変や手術・放射線などの障害の既往
3)MRIで鞍部病変、下垂体低形成、下垂体炎を認める
4)重度頭部外傷の既往
肝機能障害や代謝異常がない患者において年齢調整されたIGF-1値が低値の場合は通常、GH不足を示唆する。しかし、IGF-1値が正常でもGHDは否定できない。よって疑わしい場合はGH分泌負荷試験が必要となる。成長障害や頭蓋内器質性疾患の合併や既往歴・治療歴、周産期異常の既往がある場合に2種類以上の負荷試験で異常があればGHDの診断となる。他の下垂体ホルモンの分泌低下が合併している場合は1種類の負荷試験の異常でGHDの診断となる。
基礎値や負荷試験の結果の解釈の際にGH分泌に影響を与える要因は、特にボーダーライン上のケースやGHとIGF-1レベルが一致しない症例では考えるべき。BMI、2型糖尿病、甲状腺機能低下症、女性の経口エストロゲン使用はすべてGH分泌を抑制する。また、ストレス、睡眠、栄養状態、運動、1型糖尿病、慢性腎不全、肝疾患、性ホルモンはGH分泌を増加させる。ビオチンを含む食品サプリメントは免疫アッセイでの信号生成に干渉する可能性があり、GHおよびIGF-1レベルが予想外に低い場合は考慮すべきである。GHR拮抗剤ペグビソマントで治療されている先端巨大症患者では、GHレベルを測定するために非交叉反応性GHアッセイを使用する必要がある。
小児のGH治療
リコンビナントヒトGHは低身長の小児の治療に投与される。米国FDAではGHD、特発性低身長、CKD、ターナー症候群、プラダー・ウィリー症候群、SHOX遺伝子のハプロ不全、ヌーナン症候群、SGA児に対するGH治療が承認されている。
小児期のGH治療による小児や成人期の悪性腫瘍の発生率の上昇は認められていない。
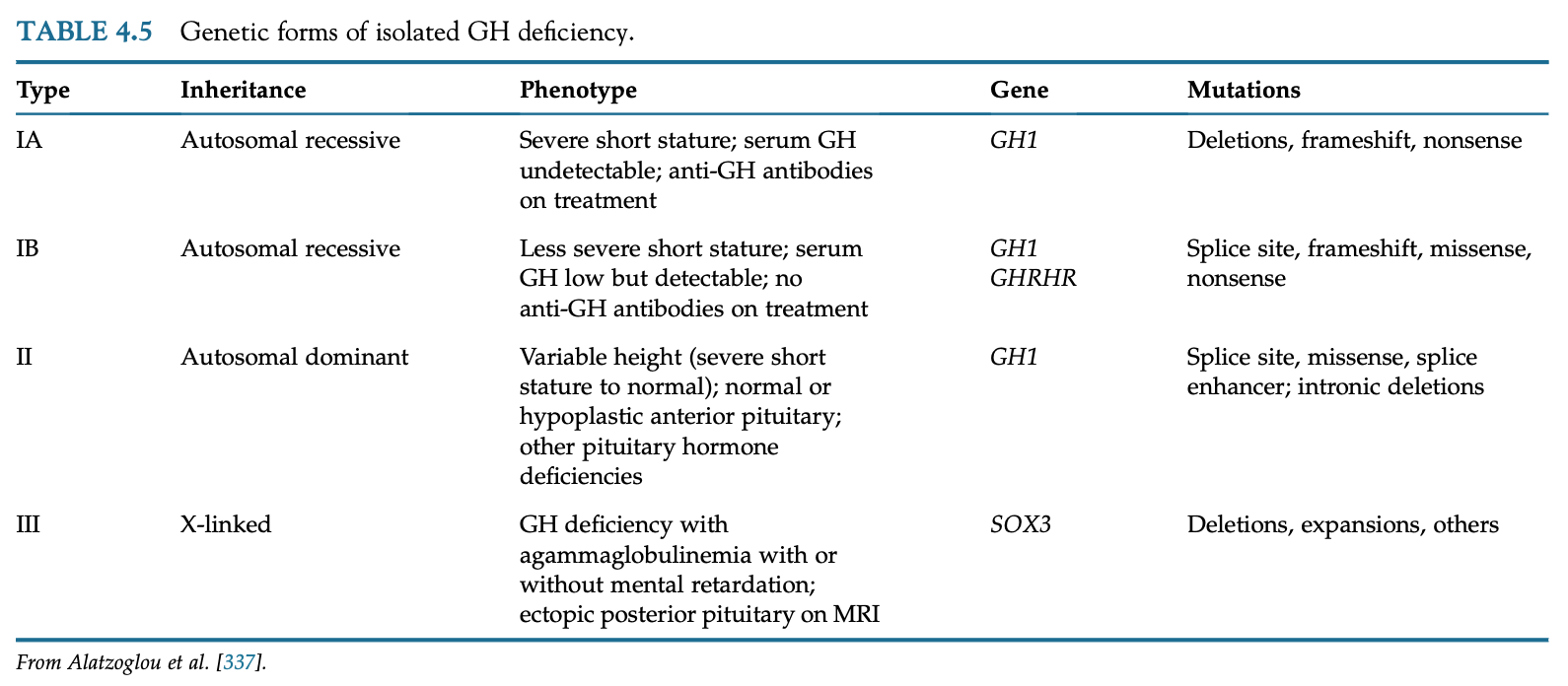
GHの単独欠乏は先天性や後天性疾患が原因となりうるが、ほとんどは特発性である。GHD患者の10%に特定可能な変異が同定される。最大30%が家族的な遺伝パターンを示す。遺伝的GH欠乏は視床下部-下垂体/GH-IGF-1軸の各レベルで起こる変異によって起こる。GHRH受容体、GH合成に関わる転写因子、GH分子自体、GH受容体の変異は全て低身長になりうる。
小児期のGHDは、重度の成長遅滞を伴うGHの完全な欠如から、低身長を引き起こす部分的なGH不足まで幅広い。診断は、低身長(同年齢の正常な子供の2.5 SD以下)、成長速度の低下(第25パーセンタイル以下)、骨年齢の遅れ、予測される成人時の身長が親の平均身長よりも低いことに基づく。甲状腺機能低下症のような併発する内分泌異常は、hGHによる成長促進効果を最大化するために補充されるべきである。治療は身長が第3パーセンタイル以下に落ちる前に迅速に開始されるべきである。全体的な身長の増加は、治療前の年齢、骨年齢、およびGH不足の重症度と反比例する。治療開始後最初の2年間に線形成長速度の最も顕著な加速が起こる。hGHの投与量と頻度はともに身長速度に影響を与える。
特発性低身長症
特発性低身長症(Idiopathic short stature; ISS)は負荷試験に対するGHの反応は正常だが、身長が5パーセントタイル以下を示し、それ以外は正常な小児をさす。この異質なグループには、家族性と非家族性ISSが含まれ、思春期の遅れがある場合とない場合がある。このグループには、まだ特定されていない突然変異を持つ子供たちも含まれている可能性がある。
ISSの子供たちは出生時には正常なサイズだが、幼児期に成長が遅く、学齢期までに平均身長が-2.0SD以下になり、身長速度は低い正常範囲内を維持する。治療されない場合の成人身長は正常範囲以下で、midparental heightより約1SD低くなる。
GH/IGF-1分泌に関連する遺伝子の遺伝的欠陥が、以前はISSとされていた低身長症において報告されており、下垂体のGHSRおよびGH1部位、GHRおよび細胞内シグナリング、GHR細胞外ドメイン(STAT5BおよびSH2)および成長板(SHOX、NPR2、ACAN、FGFR3)、およびDNA複製または修復(CHD7、FANCA、FANCC、FANCG)またはシグナル伝達(PTPN11、RAF1、PIK3R1)に関連する遺伝子が含まれる。
ISSのFDA基準を満たす子供たちの治療に関する最近のガイドラインでは、GH治療について共同意思決定アプローチを提案し、身体的および心理的負担、リスクおよび利点の評価に基づいてケースバイケースでの評価を行い、身長SDスコア(SDS)が-2.25(1.2パーセンタイル)以上のすべての子供にGHを定期的に投与するのではなく、個々に検討することを推奨している。ガイドラインでは、0.24 mg/kg/週のGHを開始することを推奨し、一部の患者は0.47 mg/kg/週まで必要とする場合があり、GH開始後および用量の最適化後12ヶ月で身長SDSおよび心理社会的影響の評価を行う。ISSの子供たちに投与されるGHは通常、治療期間に応じて成人身長を3〜7cm増加させる。ただし、GH治療に対する反応には異質性があり、一部の患者はGH治療後に身長が増加しない場合がある。ISSの小児はそれ以外では健康なので他のGH適応疾患と比べてGHの副作用が出にくい。
Turner症候群
身体的特徴、卵巣機能不全、成長率低下を示し。これらは胎内にいるときから始まり、小児から思春期にかけて続くため、成人身長は低下する。ターナー症候群の女児に対するGH治療は成人身長を伸ばす。特に治療が早期に開始され、少なくとも14歳までエストロゲン補充療法が延期される場合、身長の伸びがより大きくなる。GH治療は一部の研究で最大15cmの身長増加をもたらすが、最近のメタ分析では7cmの増加と報告されている。
SGA児
出生時の身長が平均値より少なくとも2SD以下である子供たちは、SGA児と定義される。胎児の成長不全は、特発性であるか、または母親のライフスタイル、胎盤機能不全、または胎児の遺伝的要因による可能性がある。ほとんどのSGA児は、生後1年目または2年目に「追いつき成長」を経験するが、残りの10%から15%は長期的なGH治療によって成人時の身長を約1.25SD増加する。
CKD
CKDを有する小児の40%が低身長と関連がある。これは蛋白・カロリー不足、酸塩基平衡異常、副甲状腺機能亢進症、GH上昇・IGF-1低下を示すGH不感症による可能性がある。GHクリアランスの低下によってGHの基礎値と誘発された値が高くなるが、低身長を呈する。超生理学的投与量のGHはIGF-1の分泌を刺激し、縦方向の骨の成長を促進し、成人時の身長を改善する。ガイドラインは、ステージ3~5の慢性腎疾患を持つ子供や、透析を受けている生後6ヶ月以上の子供で、成長障害の潜在的に治療可能なリスク因子の改善後も成長障害が持続する場合、毎日の皮下GH治療を推奨している。これは、子供に成長の可能性がある場合に限られる。腎移植後1年で成長障害が持続する子供は、最終身長に達するまで、または腎移植が行われるまで、数年間にわたり毎日GH補充療法を受けるべきである。2~5年のGH治療後の最終身長の予想増加は約7.2cm。
SHOX遺伝子欠損
XおよびY染色体の遠位末端に位置するSHOX遺伝子は、長管骨の成長において重要な部分を担うホメオドメイン転写因子をコードしている。欠損は、異常な軟骨細胞の増殖と分化につながり、胎内および出生後の骨の成長が遅れる。SHOX遺伝子は、ターナー症候群、Lerie-Weill症候群、および一部のISSの低身長に関与している。GH補充による身長SDSの増加は、SHOX欠損症とターナー症候群の子供たちにおいて類似しており、それぞれ1.1 ± 0.7と1.2 ± 0.8(基準値と比較してP < .001)である。
成人のGH補充
成人ではGH補充はGHD、HIV/AIDSの筋萎縮、短腸症候群に行われる。
成人成長ホルモン分泌不全症(AGHD)
AGHDは視床下部・下垂体疾患、頭蓋内放射線治療、下垂体手術や放射線治療、頭部外傷やくも膜下出血の既往がある患者において疑うべき疾患である。AGHDは単独で発症することもあれば、他の複数の下垂体ホルモンの低下症を伴うこともある(汎下垂体機能低下症)。小児期発症のGHDが成人期に続く場合と成人期に生じた下垂体病変や外傷などで生じる場合がある。下垂体の器質的疾患で最も多いのは下垂体マクロ腺腫(30-60%は1つまたは複数の下垂体ホルモン低下症を起こす)や下垂体腺腫に対する治療(手術や放射線)である。また頭部外傷後の最大20%がGHDを起こす。GHは通常下垂体に障害が生じた場合に最初に低下するホルモンであるため、複数の下垂体ホルモン低下症がある場合はGHDが合併している可能性が高い。また下垂体の放射線治療後の下垂体機能低下症は経時的に起きてくるので、治療後10年程度で50%の患者はなんらかのホルモン欠乏を呈する。
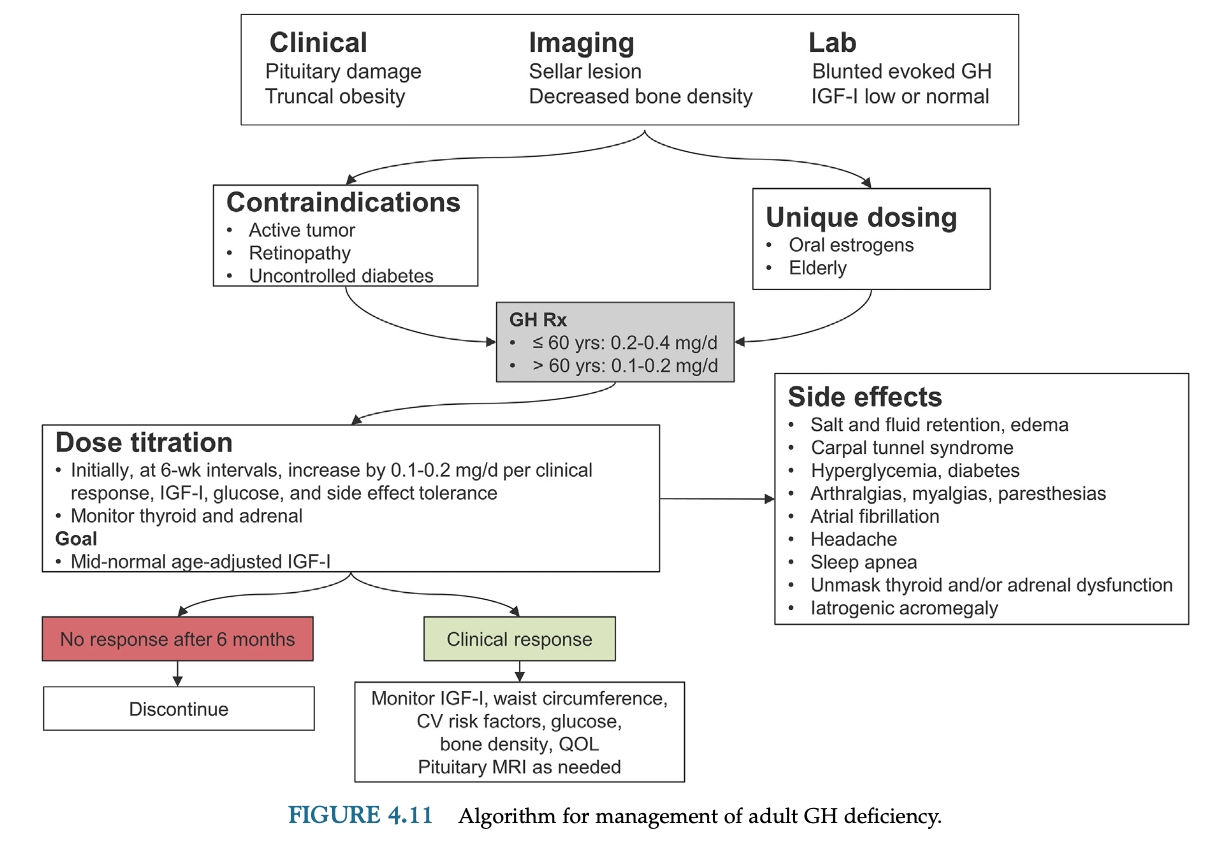
AGHDの診断
AGHDでは体組成の変化(脂肪増加、筋肉量と筋力低下)、骨密度減少、糖・脂質代謝の変化、心理社会的障害、心血管病による死亡の増加の可能性などが起きる。
IGF-1はよいスクリーニング検査であるが、重度のGHDでも正常範囲のことがある。
随時GHの測定は当てにならないので、AGHDの診断には負荷試験が必要となる。
本邦ではGHRP-2負荷試験、インスリン低血糖試験、アルギニン負荷試験、グルカゴン負荷試験などが行われる事が多い。
GHは肥満患者では低下するため、肥満患者では偽陽性に注意しなければならない。
AGHDに対するGH補充の効果
成人のGH補充の目的は代謝異常と心理社会的問題の是正である。GH補充は体組成、骨、代謝、気分・活力に良い効果をもたらす。GH補充は下垂体不全に伴う標準化死亡率を2.4から1.99に減らし、その効果は女性より男性で高い。
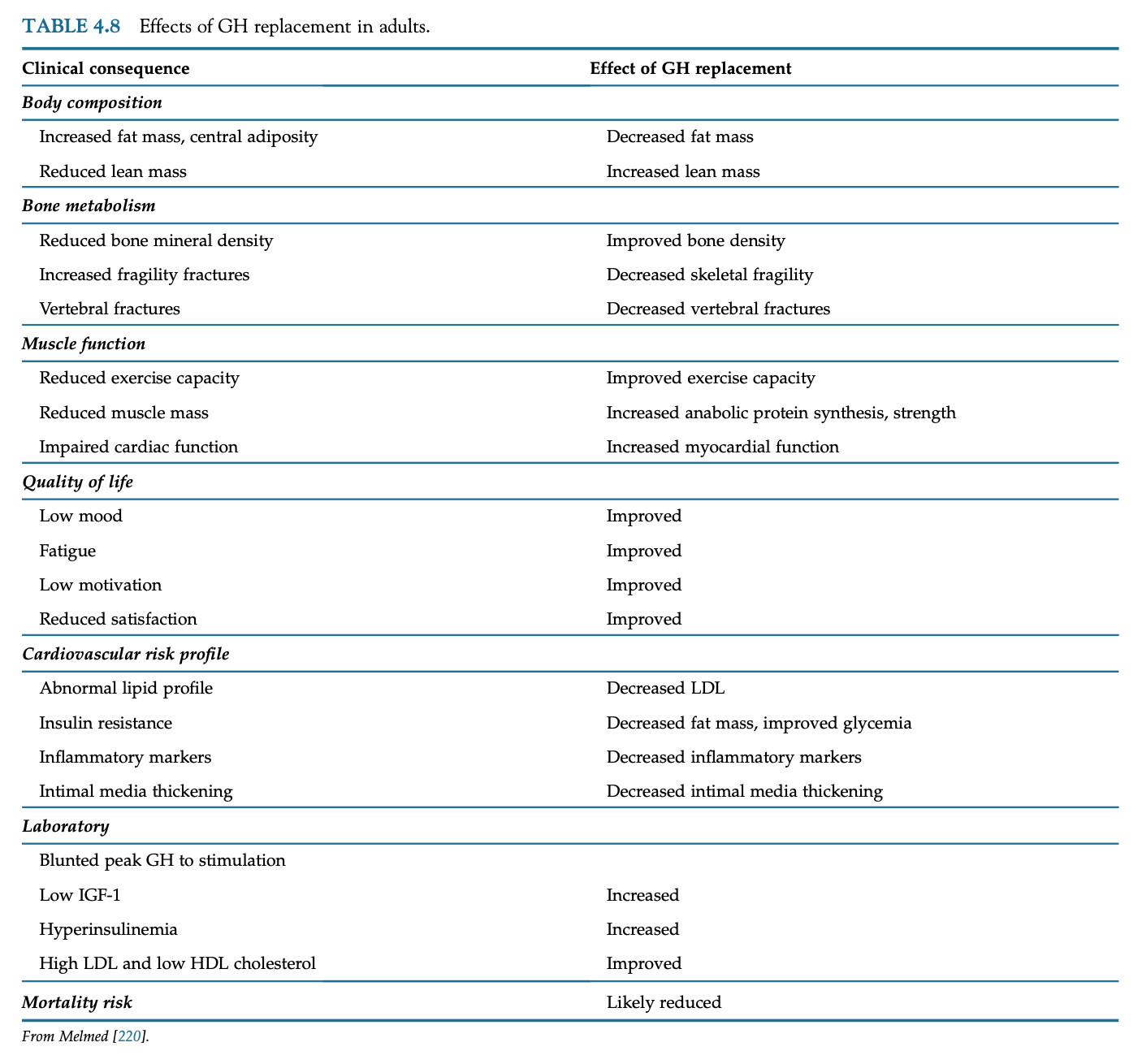
体組成や代謝への効果
37のRCTのメタアナリシスではGH補充でLDLと総コレステロールの低下が半分でみられ、残りの半分では効果がなく、HDL・中性脂肪・心血管リスク因子には効果がないと報告している。GH治療のインスリン感受性や糖尿病のリスクは相反している。
骨格筋への効果
GH補充によって骨格筋の合成が増え、蛋白の酸化が減る、テストステロンの同時投与でこの効果は増強される。また体温調節も改善し、運動時の発汗も増える。
骨密度への効果と骨折リスク
GH補充によって骨回転がよくなり、骨形成・骨吸収マーカーの両方が上がる。6年間無治療でフォローされたGHDは年齢に関係なく画像上の椎体骨折が増えていたことが報告されている。大きい観察研究ではGH補充で骨折を防げたのは介入時に骨粗鬆症がなかった患者のみであった。
GHの用量
GHの用量は患者ごとに調節が必要となる。
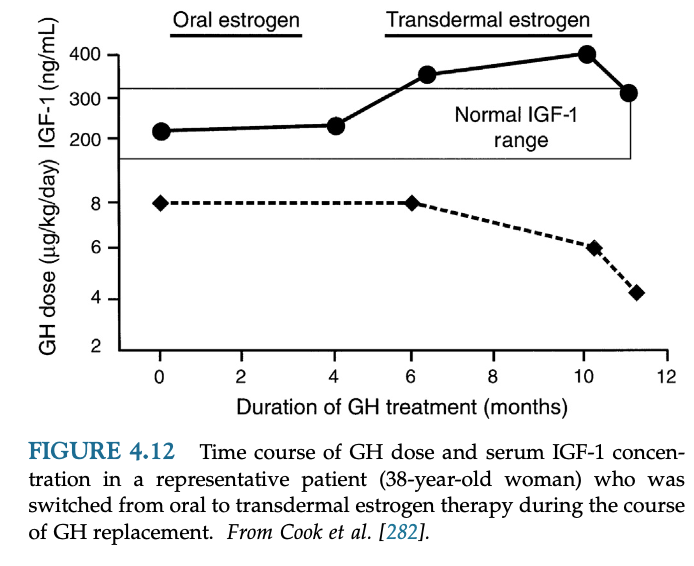
経口エストロゲン製剤使用中の女性患者はGH補充量が多く必要になる。経皮エストロゲン製剤では問題にならないことが多い。
現在の推奨開始用量は60歳未満で0.2-0.4mg/日、60歳以上は0.1-0.2mg/日である。
本邦では3µg/kg/日程度からの開始が推奨され、0.2mg/日開始が多い。高齢者では0.1mg/日で慎重に開始を検討する。投与量は効果、副作用、IGF-1値を確認しながら4-6週間隔で調節する。最大投与量は1mg/日である。投与量が調節できたら6-12ヶ月おきにモニターする。IGF-1が年齢・性別基準値の中間程度になるようにする。GH補充に伴い副腎・甲状腺ホルモン補充量の増量が必要になる患者もいることに注意する。
GH補充療法は活動性の悪性腫瘍、妊婦または妊娠している可能性のある女性には禁忌である。増殖型糖尿病網膜症、糖尿病合併例は慎重投与。
長時間作用型GH製剤では通常1.5mg/週、60歳以上では1.0mg/週、経口エストロゲン製剤服用中女性では2.0mg/週から開始し、1回あたり0.5-1.0mgの増量を検討する。IGF-1値は注射2日後に頂値、3-4日後に平均値をとるので、採血のタイミングを考慮する。
GH補充の副作用
GH補充のすぐあとに生じる短期間の副作用は液体貯留による浮腫・関節痛・手根管症候群やインスリン感受性の低下などがある。液体貯留による副作用は5-20%にみられるが減量や継続中に消失する。
高血糖
肝臓でのインスリン拮抗作用と患者によっては高用量でインスリン感受性が低下することで高血糖を生じる可能性がある。糖尿病の発症に関しては一般人口と変わらないという報告や一般人口よりも多いという報告などさまざまである。
悪性腫瘍のリスク
疫学研究ではIGF-1が正常範囲内の上位1/4と乳がん、大腸がん、前立腺癌などのコモンな癌との間に関連があるとしている。市販後の長期間のフォローアップではGH補充療法後に悪性腫瘍の発生は増えないと報告されている。40万人年の小児GH治療の報告でも明らかな増加は認めなかった。
GH補充と下垂体機能低下症
GHと他の下垂体ホルモンの間には複雑な相互作用が生じ、診断や補充療法に関わる。
甲状腺、副腎、性腺ホルモンの補充療法はGHDの検査の3ヶ月前には最適化しておかなければならない。さらにGH補充によって隠れた副腎不全や甲状腺機能低下症が顕在化することがある。GHはT4からT3への変換を促進し、T4からrT3への変換を減らす。GH補充後にチラーヂン量の増量が必要になることがある。
経口エストロゲン製剤は肝でのGH作用・IGF-1産生を阻害するため、多めのGH補充量が必要となる。GH補充量を減らすために経皮エストロゲン製剤への変更を検討するべきである。男性ホルモン補充ではGH製剤量の調節は必要ない。
先端巨大症患者へのGH補充
先端巨大症術後にGHDを呈することがたまにある。後ろ向き研究ではGHDを生じた先端巨大症患者は心血管死が非機能性下垂体腺腫術後よりも多いとされている。42例の先端巨大症患者でGH補充によりQOLの向上、体組成や脂質代謝が改善することが示されている。

〈参考文献〉
The pituitary, growth hormene, 5th edition.
間脳下垂体機能障害と先天性腎性尿崩症および関連疾患の診療ガイドライン 2023年版.