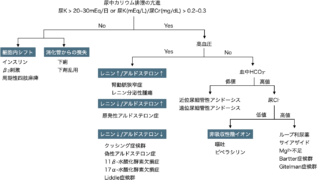
目次
推奨一覧
疫学と危険因子
Ⅰ. アスペルギルス症に最も罹患しやすい患者はどのようにして予防できるのか?どの患者が最も罹患しやすいのか。
- 同種造血幹細胞移植後の入院患者は真菌曝露を減らすために保護された環境にいるべきである。
- 急性白血病に対する寛解導入/再導入療法を受けるような侵襲性アスペルギルス症に罹患しやすい高度免疫不全患者では感染対策を同様に行うことは妥当である。
- 保護環境がない病院では、個室に入院し、工事現場とつながりがなく、食物や切り花などが部屋に持ち込まれないようにすることを推奨する。
- 侵襲性アスペルギルス症の高リスクの外来患者ではガーデニング、堆肥の散布、工事や改築に近い場所などでの真菌曝露を減らすような対策が推奨される。
- 白血病センターおよび移植センターは、侵襲性真菌感染症例のサーベイランスを定期的に行うべきである。平時より発生率が増加した場合、またはリスクが高くない患者に侵襲性真菌感染症が発生した場合は、感染源として病院を評価する必要がある。
アスペルギルス症の診断
Ⅱ. 侵襲性アスペルギルス症の診断は?
- 分子生物学的手法が臨床検査室でより広く使用されるようになるまでは、組織学的/細胞学的検査と培養検査を同時に行うために、十分な量の組織検体と体液検体を提出することを推奨する。非典型的な増殖や耐性の懸念がある分離株については、分子生物学的手法による種の同定を行うべきである。
- 侵襲性アスペルギルス症の診断における血液を用いたPCRの臨床的有用性については、委員間で議論があり、専門家の意見も一致しなかった。あるグループは、診断や抗真菌薬の先制使用を減らすために、抗原検出アッセイなど他の検査と併用した場合のPCR検査の役割を検証した論文に基づき、PCR検査の推奨に賛成した。
もう1つのグループは、PCR検査は有望であるが、市販されている検査法には決定的なバリデーションがないこと、文献に記載されている方法論が多様であること、結果がどの程度診断に役立つのか疑問であることなどから、現時点では臨床現場での日常的な使用は推奨できないと考えた。 - この分野の研究が進むにつれて、PCR法を使用する臨床医には、個々の患者の管理にケースバイケースで慎重に使用することを勧める。臨床医は使用するアッセイの方法論と性能の特徴を理解し、それに従って結果を解釈すべきである。PCR法を使用する場合、結果は他の診断検査や臨床的背景と合わせて考慮すべきである。
- 血清およびBALのガラクトマンナン(GM)は、特定の患者集団(血液悪性腫瘍、造血幹細胞移植)において使用される場合、成人および小児患者の侵襲性アスペルギルス症の診断の正確なマーカーとして推奨される。
- GMは、抗真菌薬による治療または予防を受けている患者のルーチンの血液スクリーニングには推奨されないが、そのような患者の気管支鏡検体には適用できる。
- GMは固形臓器移植患者や慢性肉芽腫性疾患(CGD)患者のスクリーニングには推奨されない。
- β-D-グルカンの血清アッセイは、高リスク患者(血液学的悪性腫瘍、同種造血幹細胞移植)の侵襲性アスペルギルス症の診断に推奨されるが、アスペルギルスに対する特異性はない。
- 胸部X線写真の結果にかかわらず、侵襲性肺アスペルギルス症が臨床的に疑われる場合はいつでも胸部CT検査を行うことを推奨する。
- 侵襲性肺アスペルギルス症が疑われる場合の胸部CT検査で造影剤を定期的に使用することは推奨されない。結節や腫瘤が大血管に近い場合は造影が推奨される。
- 侵襲性肺アスペルギルスの治療に対する反応を評価するために、最低2週間の治療後に胸部CT検査を行うことを推奨する。結節が大血管に近い場合は、より頻繁なモニタリングが必要かもしれない。
- 侵襲性肺アスペルギルス症が疑われる患者には、気管支鏡検査と気管支肺胞洗浄(BAL)を行うことを推奨する。重篤な低酸素血症、出血、血小板輸血不応性血小板減少症などの重大な合併症がある場合は、BALを施行できないことがある。末梢結節性病変ではBALの収率は低いので、経皮的肺生検または気管支内生検を考慮すべきである。標準化されたBAL手技を行い、BALサンプルをルーチンの培養および細胞診だけでなく、非培養に基づく方法(例えば、GM)にも提出することを推奨する。
Ⅲ. 侵襲性アスペルギルス症の治療および予防に使用可能な抗真菌薬にはどのようなものがあるか?
アムホテリシンB
- アムホテリシンB(AmB)デオキシコール酸塩およびその脂質誘導体は、ボリコナゾールが投与できない場合のアスペルギルス感染症の初回およびサルベージ療法に適切な選択肢である。しかし、デオキシコール酸AmBは、代替薬がない資源に乏しい環境での使用にとどめるべきである。アゾール系薬剤が禁忌または忍容性のない環境では、AmBの脂質製剤を考慮すべきである。
- 好中球減少が長期化している患者(急性白血病の寛解導入/再導入療法を受けている患者、同種造血幹細胞移植の移植片対宿主病[GVHD]のコンディショニング後または治療中)および肺移植患者における予防として、AmBのエアロゾル化製剤を考慮することができる。
エキノキャンディン系
- エキノカンディン系は侵襲性アスペルギルス症に対する救済療法(単独または併用)として有効であるが、一次治療における単剤療法としてのルーチンでの使用は推奨しない。
アゾール系
- アゾール系は、ほとんどの患者において侵襲性アスペルギルスの治療および予防に望ましい薬剤である。
- アゾール系による侵襲性アスペルギルス症の治療、長期予防内服、またはアゾール系薬剤との相互作用が予想される他の治療を受けている患者において、定常状態に達した時点でTDMを行うことが推奨される。
イトラコナゾール、ボリコナゾール、ポサコナゾール懸濁液に関する中程度のデータから、この方法は治療効果を高め、薬物曝露が最適でないことに起因する治療失敗を評価し、アゾール系抗菌薬に起因する可能性のある毒性を最小化する上で有用であることが示唆されている。ポサコナゾールの徐放製剤または静注製剤、あるいはイサブコナゾールについて、TDMが有用であるか必要であるかについては、さらなる研究が必要である。 - 臨床医は、アゾール系抗真菌薬(イトラコナゾール、ボリコナゾール、ポサコナゾール、場合によってはイサブコナゾール)およびシクロスポリン、タクロリムス、シロリムス(およびチロシンキナーゼ阻害薬などの他のCYP3A4基質)など相互作用の可能性のある薬剤について、治療効果を最適化し、両薬剤群の潜在的な毒性を回避するために、血清トラフ薬物濃度を測定すべきである。
- ポリエン系薬剤やアゾール系薬剤とエキノカンディン系薬剤の併用は、いくつかの前臨床試験において相加効果や相乗効果を示唆している。しかし、前臨床試験とin vitro試験の試験デザインにばらつきがあり、相反する結果が得られているため、試験結果をどのように解釈すべきかが不明確である。
- 初感染時に回収された分離株の定期的な抗真菌薬感受性試験(AFST)は推奨されない。
参照法を用いたアスペルギルス分離株のAFSTは、アゾール耐性分離株が疑われる患者、抗真菌薬に反応しない患者、または疫学的目的のために行う。
侵襲性アスペルギルス症
Ⅳ. 侵襲性アスペルギルス症のさまざまな臨床症状に対して推奨される治療レジメンと補助的治療手段は?
- ボリコナゾールによる初期治療を推奨する。
- 侵襲性アスペルギルス症が強く疑われる患者では精査中の早期の抗真菌薬開始が正当化される。
- L-AMB、イサブコナゾール、その他のAMB脂質製剤による代替治療がある。
- ボリコナゾールとエキノキャンディンによる抗真菌薬併用療法は、侵襲性アスペルギルス症が証明された一部の患者に考慮される。
- エキノキャンディン系による一次治療は推奨されない。エキノカンディン系抗真菌薬(ミカファンギンまたはカスポファンギン)は、アゾール系抗真菌薬やポリエン系抗真菌薬が禁忌の場合に使用できる。
- 侵襲性アスペルギルス症の治療は、免疫抑制の程度と期間、病変部位、病勢改善の証拠に大きく左右されるが、最低6~12週間継続することを推奨する。
- IPAの治療に成功し、その後の免疫抑制が必要な患者に対しては、再発予防のために二次予防を開始すべきである。
- 可能であれば、抗アスペルギルス療法の一環として、免疫抑制剤の投与量を減らすか、完全に中止することが勧められる。
- 侵襲性アスペルギルス症と診断された、または疑われる好中球減少症患者には、コロニー刺激因子を考慮してもよい。この状況における顆粒球コロニー刺激因子と顆粒球マクロファージコロニー刺激因子(GM-CSF)の価値に関するエビデンスは不十分である。
- 顆粒球輸血は、標準的治療に抵抗性または反応しそうにない好中球減少症患者で、1週間を超える投与期間が予想される場合に考慮できる。
- 遺伝子組換え型インターフェロン-γはCGD患者の予防薬として推奨されている。侵襲性アスペルギルス症に対する補助療法としての有用性は不明である。
- アスペルギルス症に対する手術は、デブリードマンが容易に可能な限局性疾患(侵襲性真菌性副鼻腔炎や限局性皮膚疾患など)に対して考慮すべきである。心内膜炎、骨髄炎、中枢神経系(CNS)病変の治療など、その他の状況における有用性は合理的であると思われる。その他の適応はあまり明確ではなく、患者の免疫状態、併存疾患、単一病巣の確認、手術のリスクなどを考慮する必要がある。
- 侵襲性アスペルギルス症は化学療法や造血幹細胞移植の絶対的禁忌ではない。
- アスペルギルス症の診断後、いつ追加化学療法または造血幹細胞移植を行うかを決定するには、感染症専門医と血液・腫瘍専門医の両方が関与すべきである。これらの決定は、その後の抗悪性腫瘍剤治療期間中にアスペルギルス症が進行するリスクと、この治療が遅れた場合の基礎にある悪性腫瘍による死亡リスクを考慮しなければならない。
難治性または進行性のアスペルギルス症(サルベージ療法)にはどのようなアプローチが必要か?
- 感染の速さ、重症度、範囲、患者の併存疾患を考慮し、新しい病原体の出現を除外するために、個別のアプローチを推奨する。一般的な救済療法としては、(i)抗真菌薬クラスの変更、(ii)免疫抑制の漸減または解除(可能な場合)、(iii)選択された症例における壊死病変の外科的切除が挙げられる。
- サルベージ療法では、現在の治療法に抗真菌薬を追加することもあれば、最初のレジメンとは異なるクラスの抗真菌薬を併用することもある。
- 現在、抗真菌薬を投与中で、この薬剤に起因する有害事象を示す患者には、別のクラスの抗真菌薬に変更するか、副作用プロファイルが重複しない別の薬剤の使用を推奨する。
- サルベージ療法には、L-AMB、ミカファンギン、カスポファンギン、ポサコナゾール、イトラコナゾールが用いられる。サルベージ療法としてトリアゾール系抗真菌薬を使用する場合は、前治療歴、宿主因子、薬物動態、抗真菌薬耐性の可能性などを考慮する必要がある。
治療に対する患者の反応を評価するためにバイオマーカーをどのように利用できるか?
- 血清GMの連続モニタリングは、ベースライン時にGMが上昇している適切な患者集団(血液悪性腫瘍造血幹細胞移植)において、疾患の進行と治療反応をモニタリングし、転帰を予測するために用いることができる。
- β-D-グルカンは、侵襲性アスペルギルス症において転帰を予測するための広範な研究は行われていない。
アスペルギルス症の小児患者に推奨される治療法とは?
- 小児のアスペルギルス症の治療には、成人患者と同じ治療法が推奨されるが、投与量は異なり、いくつかの抗真菌薬については不明である。
移植患者および非移植患者における気道アスペルギルス症の治療選択肢と侵襲性肺アスペルギルス症との違いとは?
- 気管気管支アスペルギルス症(TBA)の腐生型は、症候性または免疫抑制患者を除き、抗真菌治療を必要としない。
治療には、気管支鏡による粘液塞栓の除去が含まれる。侵襲性疾患の可能性が排除できない免疫不全患者には、アゾール系薬剤が推奨される。 - 気管支中心性肉芽腫症はアレルギー性気管支肺アスペルギルス症(ABPA)と同様に治療される。
- TBAの浸潤型は、アゾール系またはAmBの脂質製剤を静脈内投与する。
また、可能であれば、免疫抑制を最小化または逆転させ、選択された症例では気管支鏡による気道病変のデブリードマンを行うことを推奨する。 - 肺移植レシピエントでは、腐生菌型を含むTBAに対して抗真菌薬の全身投与を推奨する。また、吻合部気管支内虚血や肺移植に伴う気道虚血による虚血性再灌流障害を伴うTBAに対しては、補助的にAmBを吸入することを推奨する。抗真菌療法の期間は、少なくとも3ヵ月、またはTBAが完全に消失するまでのいずれか長い方である。
肺外アスペルギルス症のマネジメント
- 中枢神経系アスペルギルス症の第一選択薬としてボリコナゾールを推奨する。
AmBの脂質製剤は、ボリコナゾールに不耐性または難治性の場合に使用する。 - アスペルギルス性眼内炎の治療には、ボリコナゾールの内服または静脈内投与に加え、ボリコナゾールまたはAmBデオキシコール酸の硝子体内投与を行うことを推奨する。
- 侵襲性アスペルギルス性副鼻腔炎には、手術と全身ボリコナゾールまたはAmBの脂質製剤の両方を使用することを推奨するが、副鼻腔のアスペルギルスfungal ballの治療には、手術による除去のみでもよい。排膿を改善し再発を予防するためには、副鼻腔の拡大が必要な場合がある。
- アスペルギルス心内膜炎では、塞栓性合併症や弁膜症を予防するために、抗真菌療法を併用した早期の外科的介入を推奨する。ボリコナゾールまたはAmBの脂質製剤が初期治療として推奨される。感染した弁の外科的置換術後は、生涯にわたる抗真菌療法を考慮すべきである。
- アスペルギルス骨髄炎および関節炎の治療には、可能であればボリコナゾールを併用した外科的治療が推奨される。
- 皮膚病変は播種性感染を反映している可能性があるため、一次感染巣の評価に加え、ボリコナゾールによる治療を推奨する。
- 熱傷や大量の軟部組織創傷におけるアスペルギルス症では、抗真菌療法に加えて外科的デブリードマンが推奨される。
- アスペルギルス性腹膜炎では腹膜透析カテーテルを速やかに抜去し、ボリコナゾールによる全身抗真菌療法を行うことを推奨する。
- アスペルギルスによる食道・消化管への感染では出血、穿孔、閉塞、梗塞などの合併症を予防するため、ボリコナゾールの投与と外科へのコンサルテーションを勧める。
- 肝アスペルギルス症の初期治療として、ボリコナゾールまたはAmBの脂質製剤による抗真菌療法を推奨する。肝外あるいは肝周囲の胆道閉塞、あるいは内科的治療に抵抗性の限局性病変に対しては、外科的治療を考慮すべきである。
- 腎アスペルギルス症に対しては、内科的治療と泌尿器科的治療を組み合わせたアプローチを提案する。片方または両方の尿管の閉塞は、可能であれば減圧術とデオキシコール酸AmBの局所注入で管理すべきである。腎実質病変はボリコナゾールによる治療が最適である。
- 非侵襲性アスペルギルス性外耳道炎(耳真菌症とも呼ばれる)は、外耳道の徹底的な機械的洗浄に続いて、抗真菌薬またはホウ酸の外用によって治療される。
- 耳の侵襲性アスペルギルス症を治療する際には、ボリコナゾールの全身投与を長期にわたって行い、通常は手術を併用することを勧める。
- アスペルギルス性角膜炎に対しては、ナタマイシン5%点眼液またはボリコナゾール外用液の使用を推奨する。
- 非移植患者におけるアスペルギルス気管支炎の診断は、喀痰などの呼吸器分泌液中のアスペルギルス属菌の検出によって確認することを提案する。 呼吸器検体のPCRとGMは培養よりもはるかに感度が高い。
- 非移植患者におけるアスペルギルス気管支炎に対してイトラコナゾールまたはボリコナゾールの経口投与とTDMを推奨する。
侵襲性アスペルギルス症の予防
Ⅴ. 推奨される予防レジメンは何か、誰がそれを受けるべきか、そしてブレークスルー感染はどのように管理すべきか?
- 侵襲性アスペルギルス症のリスクが高い患者には、好中球減少が長引く間、ポサコナゾール、ボリコナゾール、および/またはミカファンギンによる予防を推奨する。カスポファンギンによる予防もおそらく有効であろう。イトラコナゾールによる予防は有効であるが、吸収と忍容性によって治療が制限されることがある。アゾール系薬剤は、同時投与で毒性を示す可能性があることが知られている他の薬剤(例えば、ビンカアルカロイドなど)との併用は避けるべきである。
- 侵襲性アスペルギルス症のリスクが高いGVHDを伴う同種造血幹細胞移植レシピエントには、ポサコナゾールによる予防投与を推奨する。他のアゾール系薬剤による予防も有効である。
ボリコナゾールは高リスク患者の侵襲性アスペルギルス症の予防によく使用されるが、臨床試験では生存率の改善は認められなかった。イトラコナゾールによる予防は忍容性と吸収性によって制限される。 - GVHDに伴う慢性の免疫抑制(コルチコステロイド換算で1mg/kg/日以上のプレドニゾンを2週間以上、および/または難治性GVHDに対してはリンパ球枯渇剤、TNF-α阻害薬など他の抗GVHD療法の使用)を有する患者では、免疫抑制の期間中、抗真菌薬の予防投与を継続することを推奨する。
- 肺移植後3~4カ月間は、ボリコナゾールやイトラコナゾールなどのアゾール系抗真菌薬の全身投与か、吸入用AmB製剤による抗真菌予防を推奨する。
- 肺移植前後に真菌が定着している肺移植レシピエント、摘出肺で見つかった真菌感染症、副鼻腔の真菌感染症、単肺移植レシピエントに対しては、ボリコナゾールまたはイトラコナゾールの全身投与が吸入AmBよりも推奨される。
- サイモグロブリン、アレムツズマブ、または高用量コルチコステロイドによる免疫抑制強化を受けている肺移植レシピエントには、抗真菌薬による予防投与を再開することを推奨する。
- 固形臓器移植患者においては、感染症の施設疫学と個々の危険因子の評価に基づく予防戦略を推奨する。肺移植患者以外のルーチンのアスペルギルス感染予防の必要性を検討するための前向き試験は不足している。個々の危険因子として、心移植(移植前のコロニー形成、再手術、サイトメガロウイルス感染、腎機能障害、施設での集団発生)、肝移植(劇症肝不全、再手術、再移植、腎不全)、その他、施設での集団発生や長期または高用量のコルチコステロイドの使用などが同定されている。このような患者における、最適な予防期間は不明である。
- ブレイクスルー感染に対しては感染の速さ、重症度、地域の疫学を考慮した個別のアプローチを提案する。原則としては、気管支鏡検査および/または肺末梢病変に対するCTガイド下生検により、積極的かつ迅速に特異的診断を確立することを推奨する。カビ活性のあるトリアゾール系抗真菌薬を投与されている患者では、TDMが可能であれば、血清アゾール系抗菌薬の濃度を確認すべきである。抗真菌療法は、経験的にアスペルギルス活性を有する別のクラスの抗真菌薬に変更すべきである。
可能であれば、基礎疾患である免疫抑制の軽減、患者から分離されたアスペルギルス菌の感受性試験なども考慮すべきである。
Ⅵ. いつ経験的治療を行うべきか?
同種造血幹細胞移植レシピエントおよび急性骨髄性白血病治療患者において、経験的戦略および先制的戦略としてどのようなものが推奨されるか?
- 広域抗生物質療法にもかかわらず発熱が持続する、長期の好中球減少状態の高リスク患者には、抗真菌薬の投与が推奨される。抗真菌薬の選択肢としては、AmB脂質製剤、エキノキャンディン(カスポファンギンまたはミカファンギン)、ボリコナゾールなどがある。
- 好中球減少の期間が短いと予想される患者(好中球減少の期間が10日未満)には、他の所見から侵襲性真菌感染症(IFI)が疑われる場合を除き、経験的な抗真菌薬の投与は推奨されない。
- GMやβ-D-グルカンなどの血清またはBALの真菌バイオマーカーを無症候性または発熱している高リスク患者の抗真菌療法のガイドに用いること(しばしば先制的またはバイオマーカー主導型抗真菌療法と呼ばれる)は、不必要な抗真菌薬投与を減らすことができる。
- 侵襲性肺アスペルギルス症が強く疑われる患者には、診断的評価を行う間、早期に抗真菌療法を開始することが正当化される。
- アゾール系による予防または経験的抑制療法においてブレイクスルーによる侵襲性肺アスペルギルス症が疑われる、または確定した場合の管理は、臨床試験によるデータはないが、他の薬物クラスへの切り替えが提案される。
侵襲性肺アスペルギルス症が疑われる患者の管理において、肺移植レシピエントは他の免疫抑制患者とどのように異なるか?
- 抗真菌薬の予防投与を受けていない肺移植レシピエントでは、肺移植後6ヵ月以内または3ヶ月以内に拒絶反応に対して免疫抑制を強化した気道にアスペルギルスが定着した無症候性患者に対して抗真菌薬による先制治療を行うことを推奨する。
- 肺移植後6ヵ月が経過し、拒絶反応に対する免疫抑制増強療法を最近受けていない場合は、アスペルギルスの気道定着に対する抗真菌療法を控えることが賢明である。
慢性・腐生アスペルギルス症
VII. 慢性アスペルギルス症、アレルギー性症候群、非侵襲性症候群はどのように管理すべきか?
- 慢性空洞性肺アスペルギルス症(CCPA)の診断には、(i)空洞・胸膜肥厚・胸膜周囲浸潤影・時には真菌球を伴う、3ヵ月間の慢性肺症状または慢性疾患、または進行性の画像異常、(ii)アスペルギルスIgG抗体の上昇またはその他の微生物学的データ、(iii)免疫不全がないか、または最小限であり、通常は1つ以上の基礎肺疾患があること、などが必要である。
アスペルギルスIgG抗体検査は最も感度の高い微生物学的検査である。
喀痰アスペルギルスPCR検査は培養よりも感度が高い。 - 肺症状・体重減少・著明な倦怠感を伴わないCCPA患者、肺機能に大きな障害や緩徐な低下がないCCPA患者は、抗真菌療法を行わずに3~6ヵ月ごとに経過観察してもよい。
- 肺症状または全身症状、進行性の肺機能低下または画像所見の進行のいずれかを認めるCCPA患者は、最低6ヵ月間の抗真菌療法を受けるべきである。
- 経口抗真菌薬としては、イトラコナゾールとボリコナゾールの経口投与が望ましい。ポサコナゾールは、有害事象や臨床的失敗がある場合に有用な第3選択薬である。
- 喀血に対しては、トラネキサム酸の内服、気管支動脈塞栓術、再発予防のための抗真菌療法が行われる。これらの治療が無効の場合は外科的切除が必要となる。
- 治療の失敗、アゾール耐性、有害事象などの場合には、ミカファンギン、カスポファンギン、AmBを静脈内投与することで一定の効果が得られる。治療の延長が必要かもしれない。
- 外科的切除は、汎アゾール耐性アスペルギルス感染症や気管支動脈塞栓術にもかかわらず喀血が持続する患者など、内科的治療に反応しない限局した病変を有する一部の患者に対する選択肢である。
手術による転帰は、単一のアスペルギローマによる転帰よりも不良であり、外科的介入に先立って慎重なリスク評価が必要である。 - 病勢が進行している場合には、病勢をコントロールするために、毒性や耐性を継続的に観察しながら、長期的、さらには生涯にわたる抗真菌療法が必要となる。
肺のアスペルギルス真菌球(アスペルギローマ)の治療法は?
- アスペルギローマが1個で、6~24ヵ月間に空洞の大きさに進行が見られない無症状の患者は、引き続き観察すべきである。
- 単一のアスペルギローマで症状、特に重大な喀血がある患者は、禁忌がなければ切除すべきである。
- 術前後抗真菌療法はルーチンでは必要ないが、アスペルギローマの外科的流出のリスクが中等度(空洞の位置と形態に関連)であれば、アスペルギルス膿胸を予防するためにボリコナゾール(または他の活性があるアゾール系)またはエキノキャンディンによる抗真菌療法が推奨される。
アレルギー性アスペルギルス症
喘息および嚢胞性線維症患者におけるアレルギー性気管支肺アスペルギルス症の鑑別と管理は?
- アスペルギルス免疫グロブリンE(IgE)および総IgEの上昇は、診断を確定するために推奨され、スクリーニングに有用である。
- コルチコステロイドの内服または吸入治療にもかかわらず、気管支拡張症または粘液塞栓を有する症候性喘息患者には、TDMを伴うイトラコナゾールの内服治療を行うことを推奨する。
- 増悪の頻度が高く、かつ/または強制呼気量1(FEV1) が低下しているCF患者においては、副腎皮質ステロイドの使用を最小限に抑えるため、TDMを行いながら経口イトラコナゾ ールによる治療を推奨する。治療レベルを達成できない場合は、他のアゾール薬を考慮する。
アスペルギルス属によるアレルギー性真菌性鼻副鼻腔炎の医療管理とは?
- 鼻ポリポーシスと厚い好酸球性粘液を有する患者では、粘液中の菌糸を可視化することにより、アレルギー性真菌性鼻副鼻腔炎の診断を確定することを推奨する。抗アスペルギルスIgE血清抗体検査陽性または皮膚プリックテスト陽性(可能な場合)は診断の支持所見となる。
- 再発は多いが、症状コントロールと寛解導入の最適な手段として、ポリープ切除術と副鼻腔洗浄を推奨する。
- 特に手術後に投与する場合は、症状を軽減し、再発までの期間を長くするために鼻用ステロイド外用薬の使用を推奨する。
- 難治性感染症や急速に再発する場合は、アゾール系を用いた経口抗真菌療法を推奨するが、この方法は部分的にしか有効ではない。
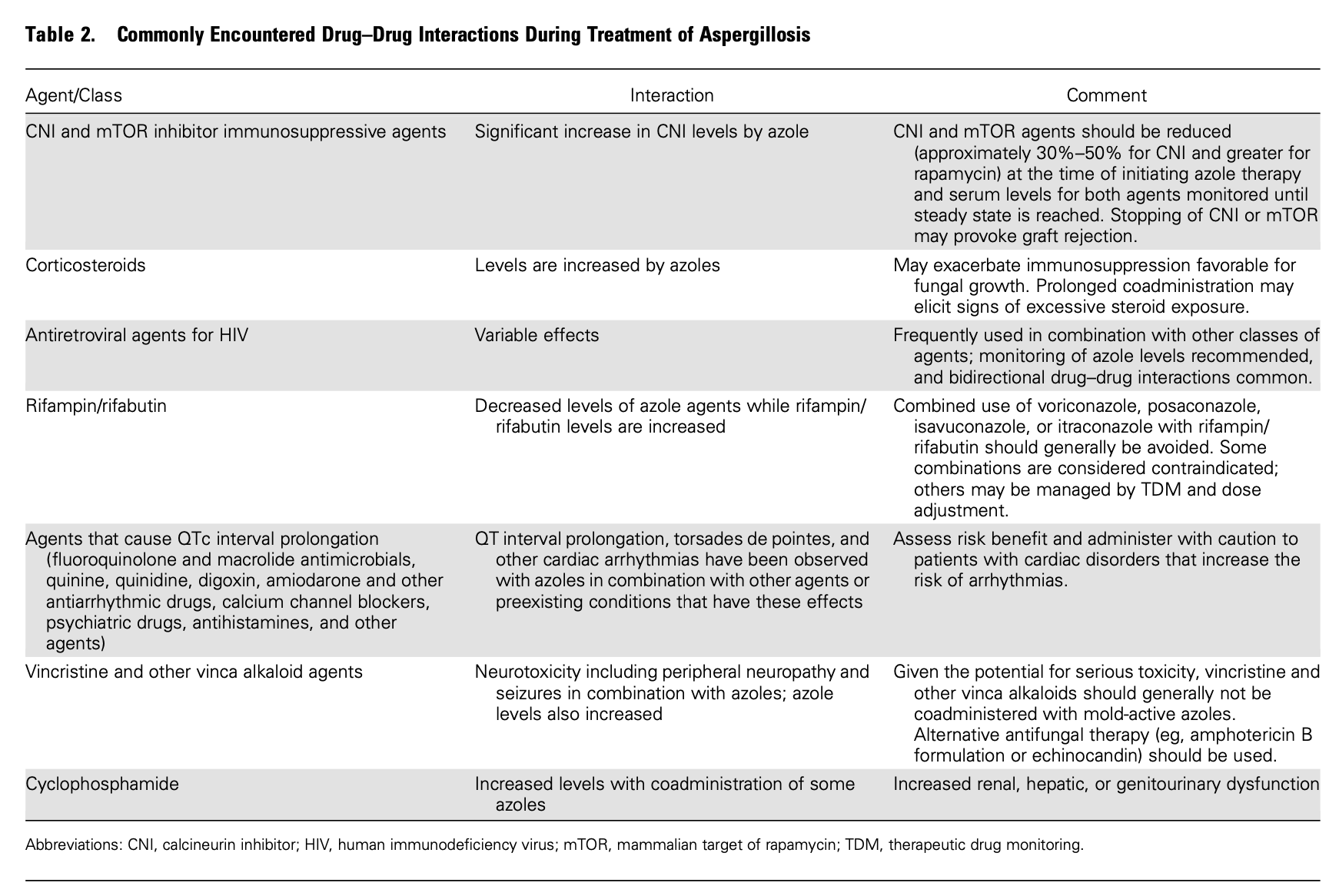
アスペルギルス症の治療推奨のまとめ
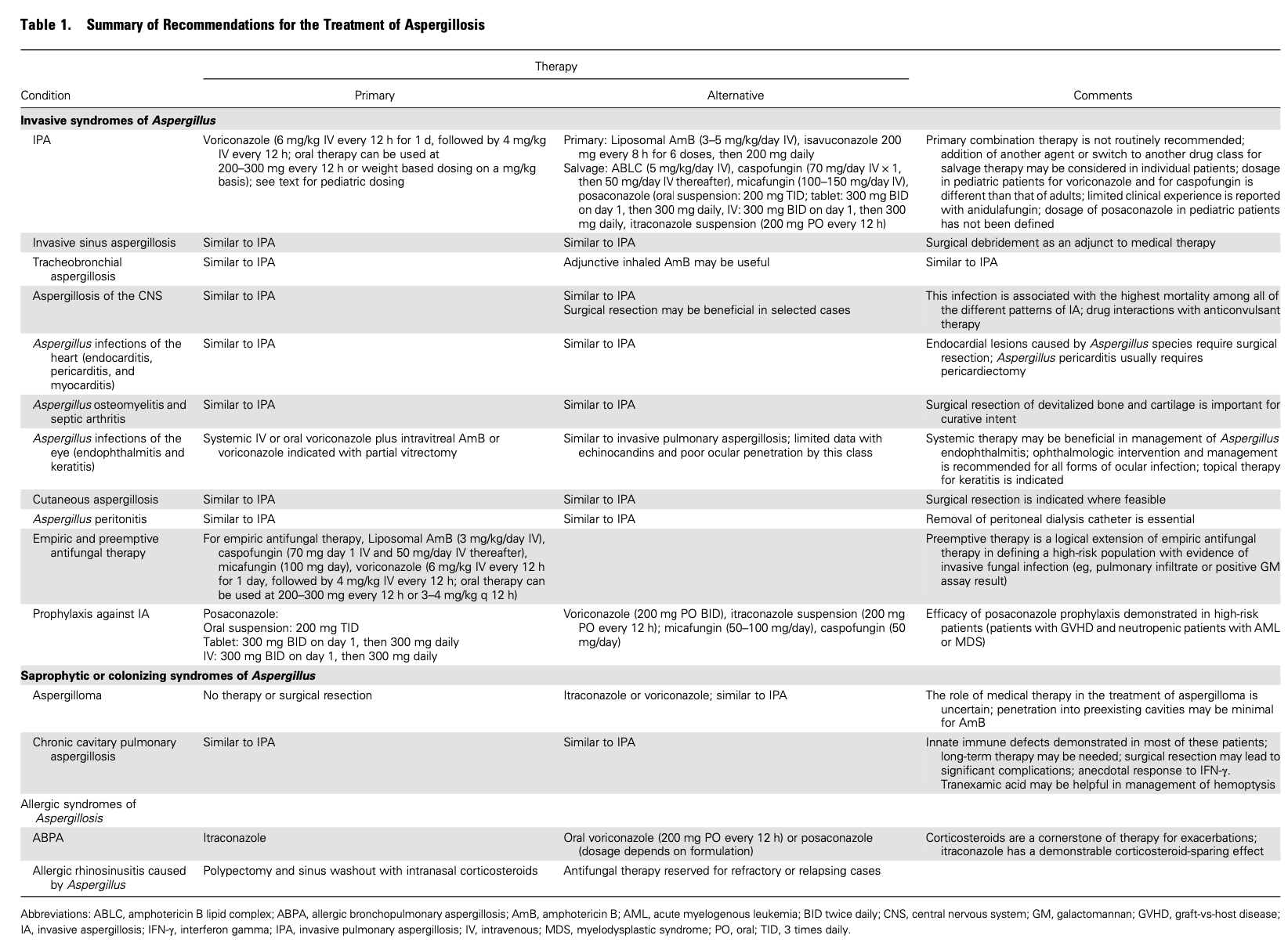
アスペルギルス症の治療においてよくある薬物相互作用
アスペルギルス症の治療においてTDMが役立つ臨床状況