最近、免疫不全患者におけるM. chelonaeによる播種性感染症、M. fortuitumによる手術部位感染症の症例を経験したのでRGMに関してお勉強。
・迅速発育抗酸菌のうち重要なのはM. abscessus、M. fortuitum、M. chelonaeの3菌種である。
・M. abscessusは難治性の慢性肺感染症、M. fortuitumは免疫不全のない患者における皮膚軟部組織感染や手術部位感染症、M. chelonaeは免疫不全患者において播種性感染症を起こすことが多い。
・M. abscessusとM. fortuitumはerm遺伝子を有するためマクロライド耐性のことが多いが、M. abscessusによる肺感染症の治療においてマクロライド感受性がある場合は予後が良いので、14日間の培養を行いマクロライド誘導耐性の有無を確認する。
はじめに
迅速発育抗酸菌(rapid growing mycobacteria, RGM)は通常1週間以内に培養される非結核性抗酸菌で、水や土壌など環境中に生息する環境常在菌である。ヒトに感染するRGMで多いのはM. abscessus、M. chelonae、M. fortuitumの3菌種である。感染部位は皮膚軟部組織、肺が多い。免疫不全患者では播種性感染症を起こしうる。他には術後の創部感染症、デバイス感染(血管内カテーテル、ペースメーカー)、腹膜透析の出口部の感染症と腹膜炎、骨髄炎などを生じる。
分類
Mycobacterium fortuitum
皮膚RGM感染症の約60%、カテーテル関連と手術部位RGM感染症の約60-80%を占める。M. fortuitumの皮膚軟部組織感染症は単独病変がほとんどで(89%)、多発病変の場合は免疫抑制患者が多い。*M. chelonaeとM. abscessusは複数病変が多い(62%)。
肺感染症を起こすことは稀で、呼吸器検体から検出されたM. fortuitumのほとんどは気管支拡張症など肺疾患の既往があり、治療を要さない定着や一過性の感染である。M. fortuitumの肺感染症はアカラシア・慢性嘔吐などの背景疾患が多い。
Mycobacterium chelonae
主に免疫抑制患者において、播種性感染症を起こす。
グルココルチコイド内服例に多く、関節リウマチやSLEなどの自己免疫疾患患者に多い。
手術部位感染症や角膜炎なども起こしうる。
Mycobacterium abscessus
RGMの呼吸器感染症の約80%を占める。
陳旧性肺結核、他の菌種による肺NTM症の先行、嚢胞性線維症、気管支拡張症など基礎肺疾患が認められる場合が多い。画像所見は肺MAC症に類似するが、空洞を呈する比率が高い。病変は肺MAC症より広範囲にわたることが多い。
術後や外傷後に皮膚病変を起こすことや、免疫不全患者では播種性病変を起こしうる。
M. abscessusは多剤耐性の非結核性抗酸菌症で治療が最も難しい。
subspeciesとして以下の3種類がある。
M. abscessus subspecies abscessus
M. abscessus subspecies bolletii
M. abscessus subspecies missilliense
可能であればsubspeciesまで同定することが重要。abscessusとbolletiiは例外はあるがマクロライド耐性(erm)遺伝子を持っており、massilienseは基本的にもっていない。これは治療の際にマクロライド系を用いるかどうかに関わってくる。
RGM感染症のリスク
免疫不全
悪性腫瘍、TNF-α阻害薬やグルココルチコイドの使用、好中球減少、IFNγとIL-12欠損症、固形臓器・造血幹細胞移植後など。
肺病変のリスク
既存の肺病変:気管支拡張症、以前の抗酸菌感染、嚢胞性線維症、肺気腫、珪肺、リポイド肺炎、α1アンチトリプシン欠損症
消化器疾患:慢性誤嚥、アカラシア
女性の骨格異常:側弯症、漏斗胸、僧帽弁逸脱症
皮膚軟部組織感染症のリスク
入れ墨、鍼療法、衛生状態の悪い浴槽を用いた足のネイル
中心静脈カテーテルなど
マクロライド耐性
RGMのマクロライド耐性には2つの機序がある。
①突然変異耐性
23S rRNA遺伝子(rrl遺伝子)の変異でマクロライド耐性になる。これは標準的な培養時間(例えば3~5日間)を用いた感受性試験法で検出され、MICは耐性範囲となる。
②誘導型耐性
erm遺伝子は誘導型のマクロライド耐性遺伝子である。活性型のerm遺伝子を有する株はマクロライド曝露中に耐性となる。通常の培養期間では感受性と判定されてしまうことがあるが、14日間の延長の培養検査でerm遺伝子の誘導型耐性を検出できる。
ほとんどのM. abscessus subspecies abscessus, M. abscessus subspecies bolletii, M. fortuitum isolatesは活性型のerm遺伝子を有している。一方でほとんどのM. abscessus subspecies massiliense と M. chelonaeはerm遺伝子を有していない。しかし、菌種の同定だけではerm遺伝子の活性を予測することはできない。通常erm遺伝子が活性であるはずの分離株の中には、erm遺伝子に変異があり、不活性化してin vivoでのマクロライド感受性を回復しているものがある。
分子生物学的検査では、erm遺伝子およびerm遺伝子の不活性化変異を検出することができ、erm遺伝子の活性を間接的に証明することができる。しかし、erm遺伝子の機能性を直接示すことができるのは、マクロライド培養による表現型薬剤感受性試験のみである。したがって、これらの種については、マクロライド培養による表現型薬剤感受性試験でerm遺伝子の活性を判定することを提案する。
マクロライド感受性の判定(誘導性耐性の除外を含む)は、治療において極めて重要である。M. abscessusの場合、マクロライド感受性株に対するマクロライド含有レジメンの使用は治療成功率が上がり、マクロライド耐性は治療効果の低さと関連する。
M. abscessus
通常感受性:アミカシン90%、クロファジミン90%、セフォキシチン70%、チゲサイクリン(ブレイクポイントの設定ないがほとんどMIC < 1mcg/mLである)
ときに感受性:イミペネム50%、リネゾリド23%
vitroで感受性がありそう:オマダサイクリン、テジゾリド、ベダキリン
クラリスロマイシンの感受性はerm遺伝子活性の有無による。
ほとんどのM. abscessus subspecies abscessusとM. abscessus subspecies bolletiiは活性型erm遺伝子を有しマクロライド耐性である(M. abscessus subspecies abscessusの約20%は不活性型のerm遺伝子を有しマクロライド感受性)。
ほとんどのM. abscessus subspecies missillienseはerm遺伝子活性がなく、マクロライド感受性である。
M. fortuitum
M. abscessusと比べて基本的に抗菌薬に対する感受性は良いが、マクロライド系はerm遺伝子のため誘導耐性となる。
通常感受性:アミカシン100%、イミペネム100%、フルオロキノロン100%、スルファニルアミド100%、リネゾリド86%、セフォキシチン80%
ときに感受性:ドキシサイクリン・ミノサイクリン50%
マクロライド:erm遺伝子活性のため耐性。
M. chelonae
erm遺伝子を有さないためマクロライド系に感受性を有する。またアミノグリコシドはアミカシンよりトブラマイシンのほうが感受性がよい珍しいNTMである。
通常感受性:クラリスロマイシン100%、トブラマイシン100%、アミカシン80%、モキシフロキサシン75%、チゲサイクリン(ほとんどMIC < 1mcg/mL)
ときに感受性:イミペネム60%、リネゾリド54%、クロファジミン25%、ドキシサイクリン25%、シプロフロキサシン・レボフロキサシン20%
薬剤感受性検査
RGMに対してCLSIが推奨する感受性検査が対象となる抗菌薬はクラリスロマイシン、アミカシン、イミペネム、セフォキシチン、リネゾリド、シプロフロキサシン、モキシフロキサシン、ドキシサイクリン or ミノサイクリン、ST合剤、M. chelonaeにのみトブラマイシンである。Up to dateではチゲサイクリンとクロファジミンも推奨されている。
M. abscessusとM. fortuitumはerm遺伝子の活性化をテストする。これはクラリスロマイシン14日間の培養前後でMICを測定することで判定する。
治療
RGMの治療に関してRCTは存在しない。推奨はケースシリーズ、感受性結果、専門家の経験に基づく。
M. fortuitum と M. chelonaeの治療
局所の皮膚軟部組織感染症
感受性がある経口抗菌薬を最低2剤、最低4ヶ月間行う。
単剤治療は耐性化や治療失敗のリスクがあるので行わない。
感受性結果に応じて以下の抗菌薬から2剤選ぶ。
・M. chelonaeはerm遺伝子を有さないためクラリスロマイシン(500mg1日2回)またはアジスロマイシン(250-500mg/日)を用いる。
・ST合剤(4錠分2)
・ドキシサイクリン(100~200mg/日)
・レボフロキサシン(500-750mg/日)
他に感受性の可能性がある抗菌薬はモキシフロキサシン、リネゾリド、ミノサイクリン、クロファジミンなど。
重症、進行性の感染症
3剤(少なくとも1,2剤は点滴)併用療法の初期治療が推奨される。
初期治療は臨床的改善が明らかになるまで継続する(2-6週間)。
その後は感受性がある経口内服薬2-3剤に変更する。
肺疾患では痰培養が陰性になってから最低でも12ヶ月間行う。
重症の皮膚軟部組織感染症、骨髄炎、播種性疾患では最低6-12ヶ月間治療する。
点滴初期治療のレジメン
アミノグリコシド+イミペネム+レボフロキサシン
①アミノグリコシド
M. fortuitum:アミカシンが望ましいアミノグリコシド。アミカシン10-15mg/kgで開始する。週3回で治療する専門家もいる。ピークの薬物血中濃度をMIC以上(MIC≤16mcg/mLの場合はMICの2-3倍以上が望ましい。)にする。
M. chelonae:トブラマイシンが望ましい。アミカシンが効く株もいる。5mg/kg/dayで投与する。週3回で治療する専門家もいる。
②イミペネム (0.5-1.0g点滴、1日2回)
③レボフロキサシン (500-750mg、点滴もしくは内服1回)
内服治療のレジメン
・ST合剤 4錠分2
・ドキシサイクリン 100-200mg/日
・レボフロキサシン 500-750mg/日
・M. chelonaeはerm遺伝子を有さないためクラリスロマイシン(500mg1日2回)またはアジスロマイシン(250-500mg/日)を用いる。
他にM. fortuitumとM. chelonaeに感受性を示しうる薬剤はチゲサイクリン、モキシフロキサシン、リネゾリド、ミノサイクリン、クロファジミンなど。
M. abscessusの治療
マクロライド感受性か耐性かによって治療レジメンや効果は異なる。
マクロライド感受性のM. abscessus
M. abscessus subspecies massilienseや他のM. abscessus subspeciesで活性型のerm遺伝子をもたない場合、マクロライドが治療のkeyとなる。マクロライド耐性よりも治療反応がよく、予後も良い。
初期治療
マクロライドと2剤の併用、そのうち1つは点滴製剤を用いる。
①アジスロマイシン250-500mg/日 or クラリスロマイシン 500mg1日2回
②アミカシン or イミペネム or セフォキシチン
③チゲサイクリン or テジゾリド or リネゾリド
本邦ではAMK点滴+IPM点滴+マクロライド系内服+クロファジミンなど。
メンテナンス治療
マクロライド感受性のM. abscessusの点滴治療のあとに経口/吸入のメンテナンス治療に移行する。
経口のマクロライドと他の2剤、アミカシン吸入250-500mg(肺病変のみ)、オマダサイクリン(本邦未発売)、テジゾリド、リネゾリド600mg、クロファジミン100mgなどを投与する。
経口投与への望ましい移行時期は明らかでない。
アミカシン+クロファジミン、アジスロマイシン+クロファジミンはアミカシンやアジスロマイシンへの耐性リスクがあるため推奨されない (UpToDate)。
治療期間
肺病変:培養陰性から最低12ヶ月
重症の皮膚軟部組織感染症、骨髄炎、播種性感染:最低6-12ヶ月
マクロライド耐性のM. abscessus
M. abscessus subspecies abscessus、 M. abscessus subspecies bolletiiなどの活性型erm遺伝子を有する株や他のマクロライド耐性株では、アミカシン点滴と最低3剤(そのうち1剤は点滴)の併用を行う。
初期治療
①アミカシン 10-15mg/kg/日
②イミペネム 1.0g 2回
③オマダサイクリン(望ましい、点滴もしくは経口投与可能)or チゲサイクリン
④テジゾリド(望ましい) or リネゾリド 600mg
⑤クロファジミン 100mg
基本的にマクロライド耐性のM. abscessusの肺感染症は治癒は難しいので、外科的切除を常に検討すべきである。外科的切除を行ったほうが治癒率は高い。
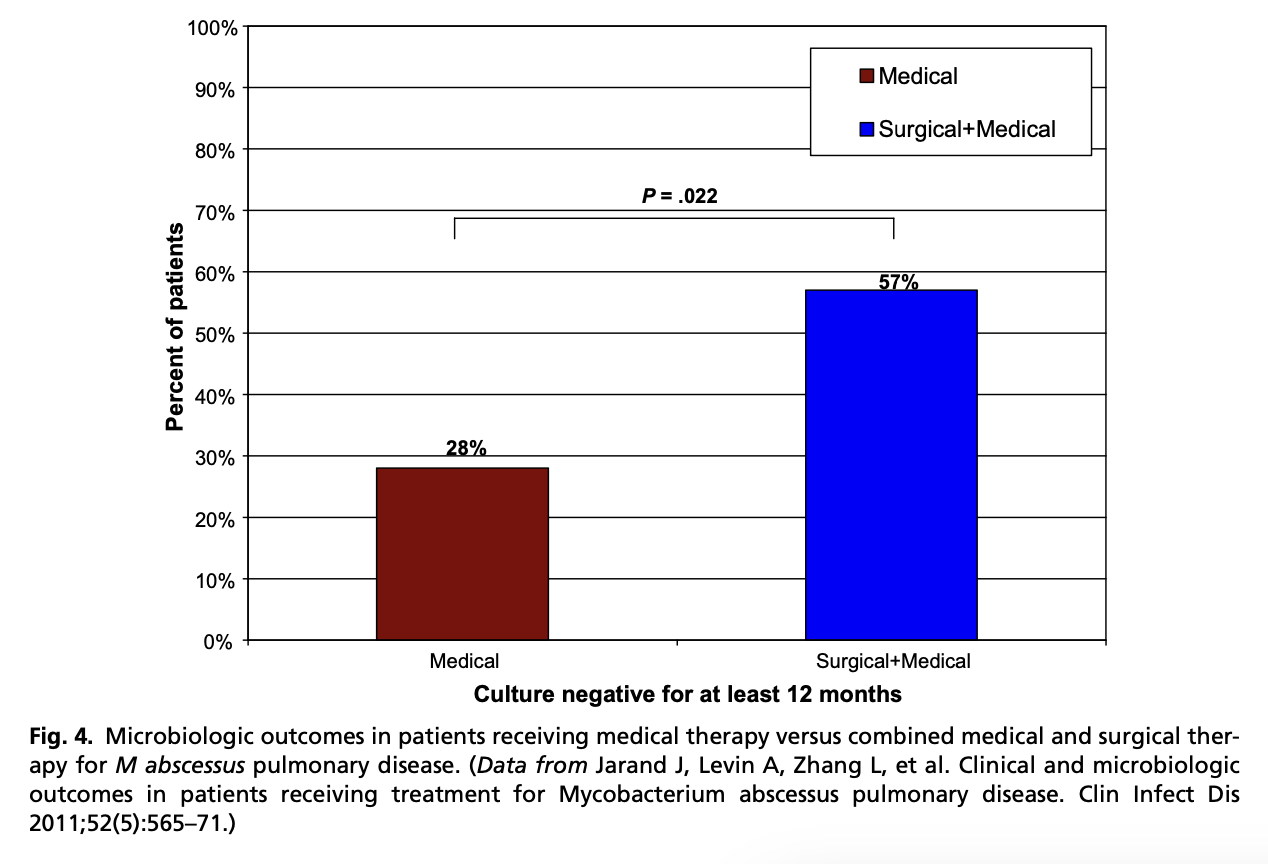
システマティックレビューではM. abscessus subspecies abscessusの肺感染のうち再発なく培養が陰性になるのは23%のみと報告されている。アミカシン点滴を用いたレジメンは痰培養陰性になることが多いとされているが、それでも39%のみである。経口投与への移行のタイミングは決まっていない。2-4ヶ月点滴して、内服に移行して1年以上という報告が多い。内服で感受性がある可能性がある抗菌薬はクロファジミン、オマダサイクリン、テジゾリドまたはリネゾリド、おそらくベダキリンも。肺病変で感受性がある場合はアミカシン吸入を用いる。
治療期間
肺病変は培養陰性から1年間以上が目標だが、マクロライド耐性株では難しい。
肺外病変では6-12ヶ月
・迅速発育抗酸菌のうち重要なのはM. abscessus、M. fortuitum、M. chelonaeの3菌種である。
・M. abscessusは難治性の慢性肺感染症、M. fortuitumは免疫不全のない患者における皮膚軟部組織感染や手術部位感染症、M. chelonaeは免疫不全患者において播種性感染症を起こすことが多い。
・M. abscessusとM. fortuitumはerm遺伝子を有するためマクロライド耐性のことが多いが、M. abscessusによる肺感染症の治療においてマクロライド感受性がある場合は予後が良いので、14日間の培養を行いマクロライド誘導耐性の有無を確認する。
【参考文献】
UpToDate: Rapidly growing mycobacterial infections: Mycobacteria abscessus, chelonae, and fortuitum 2025.4.3閲覧
DynaMed: Rapidly Growing Mycobacterial Infections. 2025.4.3閲覧
成人肺非結核性抗酸菌症化学療法に関する見解 2023年改訂
The treatment of rapidly growing mycobacterial infections. Clin Chest Med. 2015 Mar;36(1):67-78.
Rapidly Growing Mycobacteria. Microbiol Spectr. 2017 Jan;5(1):10.1128/microbiolspec.tnmi7-0027-2016.